文档内容
2025届高三年级第三次月考化学试卷 B. 分子中碳原子的杂化方式有两种
本卷可能用到的相对原子质量:H—1 O—16 Na—23 C—12 Cl—35.5 Au--197 Se-79 C. 该有机物能使稀酸性 溶液褪色
一、单选题(每小题3分,共42分)
D. 该有机物在一定条件下与氢氧化钠发生反应,最多消耗
1.化学与生活、材料、技术等密切相关,在我国古代典籍中也涉及到较多的化学知识。下列叙
7.有科学研究提出:锂电池负极材料 由于生成 而不利于电池容量的保持。一定温度下,
述不正确的是( )
A.“温泉水滑洗凝脂”,宜丰潭山天沐温泉是中国珍贵的国宝级泉质,具有高含量的、对 利用足量重水 与含 的 负极材料反应,通过测定 可以获知 。
人体有益的偏硅酸和锶元素。偏硅酸通常简称为硅酸,是一种可溶性的弱酸
已 知 :
B.万载被誉为“花炮之乡”,唐朝炼丹家清虚子撰写了《太上圣祖金丹秘诀》,其中的
“伏火矾法”是世界上关于火药的最早文字记载。生产花炮所用的原料火药中的KNO
3
下列说法不正确的是( )
在反应中起氧化剂的作用
C.奉新是明代著名科学家宋应星的故乡,其著的《天工开物》中记载“贵者垂衣裳,煌煌 A. 可用质谱区分 和 B. 若 越大,则 越小
山龙,以治天下。贱者短褐、枲裳,冬以御寒,夏以蔽体,以自别于禽兽。是故其质则造物之
C. 与 的反应:
所具也。属草木者,为枲、麻、苘、葛。”其中枲、麻、苘、葛的主要成分都属于纤维素
D.高安被誉为“釉面砖王国”,高安在宋朝时期就开始了陶瓷生产。精美的陶瓷主要由 D. 反应所得 比 反应所得 大
无机非金属材料制成
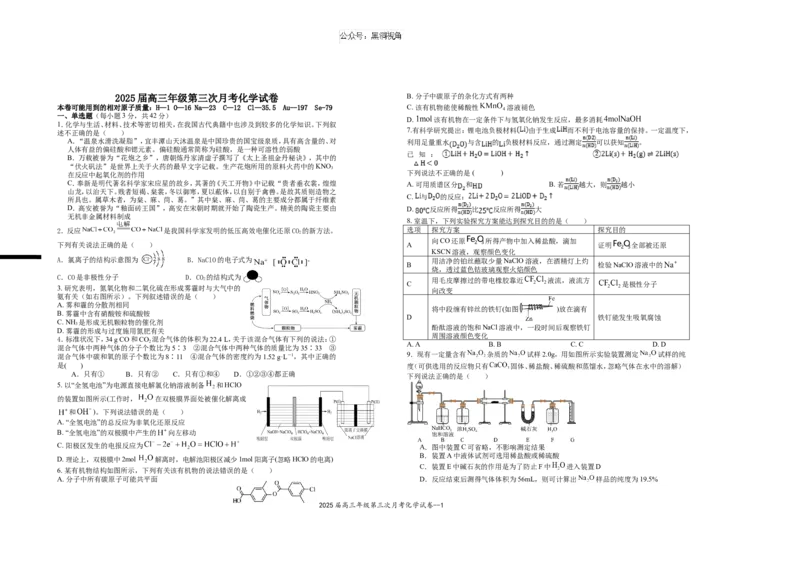
8. 室温下,下列实验探究方案能达到探究目的的是( )
2.反应 是我国科学家发明的低压高效电催化还原CO 的新方法。 选项 探究方案 探究目的
2
向CO还原 所得产物中加入稀盐酸,滴加
下列有关说法正确的是( ) A 证明 全部被还原
KSCN溶液,观察颜色变化
A.氯离子的结构示意图为 B.NaClO的电子式为 用洁净的铂丝蘸取少量NaClO溶液,在酒精灯上灼
B 检验NaClO溶液中的
烧,透过蓝色钴玻璃观察火焰颜色
C.CO是非极性分子 D.CO 的结构式为
2 用毛皮摩擦过的带电橡胶靠近 液流,液流方
C 是极性分子
3. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的
向改变
氨有关(如右图所示)。下列叙述错误的是( )
A. 雾和霾的分散剂相同
将中段缠有锌丝的铁钉(如图 )放在滴有
B. 雾霾中含有硝酸铵和硫酸铵
D 铁钉能发生吸氧腐蚀
C. NH 是形成无机颗粒物的催化剂
3
酚酞溶液的饱和NaCl溶液中,一段时间后观察铁钉
D. 雾霾的形成与过度施用氮肥有关
周围溶液颜色变化
4.标准状况下,34 g CO和CO 混合气体的体积为22.4 L,关于该混合气体有下列的说法:①
2 A. A B. B C. C D. D
混合气体中两种气体的分子个数比为5∶3 ②混合气体中两种气体的质量比为35∶33 ③
混合气体中碳和氧的原子个数比为8∶11 ④混合气体的密度约为1.52 g·L-1,其中正确的 9.现有一定量含有 杂质的 试样2.0g,用如图所示实验装置测定 试样的纯
是( ) 度(可供选用的反应物只有 固体、稀盐酸、稀硫酸和蒸馏水,忽略气体在水中的溶解)
A.只有① B.只有② C.只有①和④ D.①②③④都正确
下列说法正确的是( )
5. 以“全氢电池”为电源直接电解氯化钠溶液制备 和HClO
的装置如图所示(工作时, 在双极膜界面处被催化解离成
和 )。下列说法错误的是( )
A. “全氢电池”的总反应为非氧化还原反应
B. “全氢电池”的双极膜中产生的 向左移动
C. 阳极区发生的电报反应为 A.图中装置C可省略,不影响测定结果
B.装置A中液体试剂可选用稀盐酸或稀硫酸
D. 理论上,双极膜中2mol 解离时,电解池阳极区减少1mol阳离子(忽略HClO的电离)
C.装置E中碱石灰的作用是为了防止F中 进入装置D
6. 某有机物结构如图所示,下列有关该有机物的说法错误的是( )
A. 分子中所有碳原子可能共平面 D.反应结束后测得气体体积为56mL,则可计算出 样品的纯度为19.5%
2025届高三年级第三次月考化学试卷--110.化合物 用途广泛,所含5种短周期元素V、W、X、Y、Z原子序数递增,每个 A.“水洗”的主要目的是除去硫酸
B.“酸浸”时, 参加两个氧化还原反应
短周期均有分布,X与W处于同周期,X与Z同主族,W的基态原子价层p轨道半充满,基
态Y原子最高能级的电子排布式为 ,基态Z最高能层p轨道均有电子且有2个未成对 C.“滤渣”的主要成分是 和
电子,下列说法正确的是( ) D.“滤液2”中的金属阳离子为
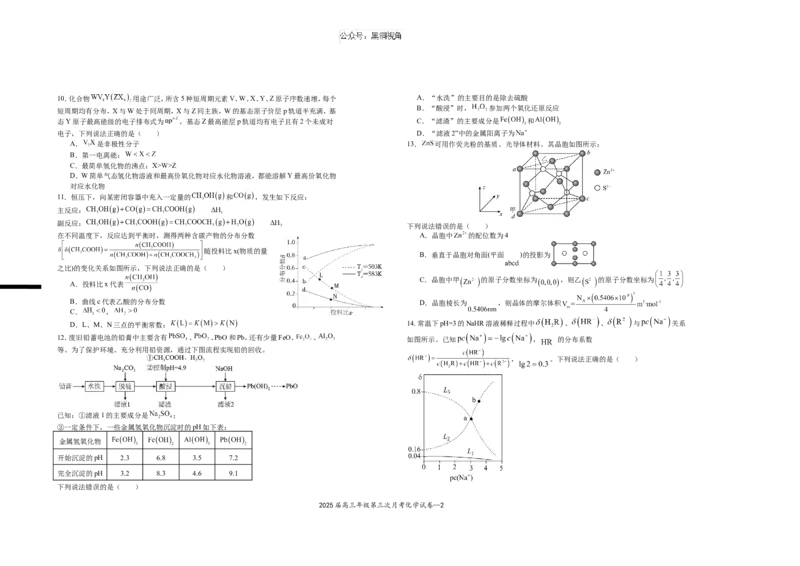
A. 是非极性分子 13. 可用作荧光粉的基质、光导体材料。其晶胞如图所示:
B.第一电离能:
C.最简单氢化物的沸点:X>W>Z
D.W简单气态氢化物溶液和最高价氧化物对应水化物溶液,都能溶解Y最高价氧化物
对应水化物
11.恒压下,向某密闭容器中充入一定量的 和 ,发生如下反应:
主反应:
副反应:
下列说法错误的是( )
在不同温度下,反应达到平衡时,测得两种含碳产物的分布分数 A.晶胞中 的配位数为4
随投料比x(物质的量
B.垂直于晶胞对角面(平面 )的投影为
之比)的变化关系如图所示,下列说法正确的是( )
C.晶胞中甲 的原子分数坐标为 ,则乙 的原子分数坐标为
A.投料比x代表
B.曲线c代表乙酸的分布分数 D.晶胞棱长为 ,则晶体的摩尔体积
C. ,
D.L、M、N三点的平衡常数: 14. 常温下pH=3的NaHR溶液稀释过程中 、 、 与 关系
12.废旧铅蓄电池的铅膏中主要含有 、 、PbO和Pb,还有少量FeO、 、 如图所示。已知 , 的分布系数
等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
, 。下列说法正确的是( )
已知:①滤液1的主要成分是 ;
②一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物
开始沉淀的pH 2.3 6.8 3.5 7.2
完全沉淀的pH 3.2 8.3 4.6 9.1
下列说法错误的是( )
2025届高三年级第三次月考化学试卷--2A. 曲线 代表 B.
C. a点溶液的pH=4.3 D. b点溶液中,
二、解答题(共58分)
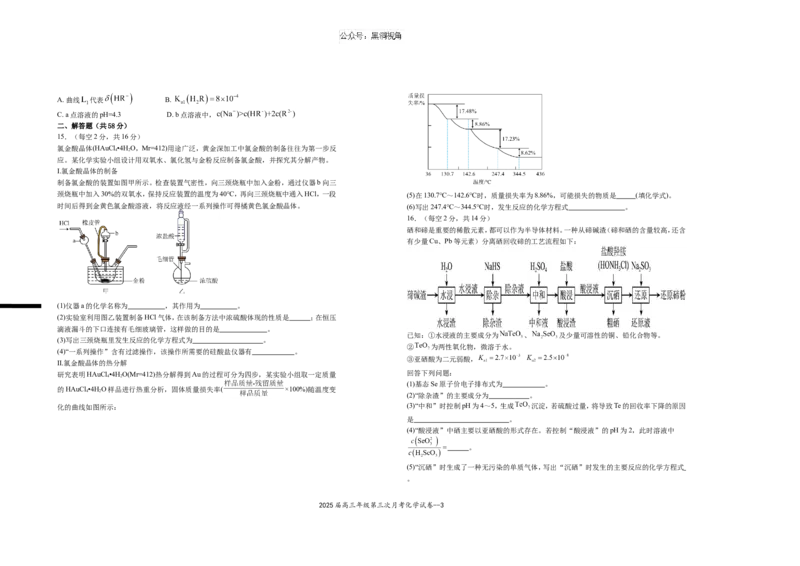
15.(每空2分,共16分)
氯金酸晶体(HAuCl •4H O,Mr=412)用途广泛,黄金深加工中氯金酸的制备往往为第一步反
4 2
应。某化学实验小组设计用双氧水、氯化氢与金粉反应制备氯金酸,并探究其分解产物。
I.氯金酸晶体的制备
制备氯金酸的装置如图甲所示。检查装置气密性,向三颈烧瓶中加入金粉,通过仪器b向三
颈烧瓶中加入30%的双氧水,保持反应装置的温度为40℃,再向三颈烧瓶中通入HCl,一段 (5)在130.7℃~142.6℃时,质量损失率为8.86%,可能损失的物质是 (填化学式)。
时间后得到金黄色氯金酸溶液,将反应液经一系列操作可得橘黄色氯金酸晶体。 (6)写出247.4℃~344.5℃时,发生反应的化学方程式 。
16.(每空2分,共14分)
硒和碲是重要的稀散元素,都可以作为半导体材料。一种从碲碱渣(碲和硒的含量较高,还含
有少量Cu、Pb等元素)分离硒回收碲的工艺流程如下:
(1)仪器a的化学名称为 ,其作用为 。
(2)实验室利用图乙装置制备HCl气体,在该制备方法中浓硫酸体现的性质是 ;在恒压
滴液漏斗的下口连接有毛细玻璃管,这样做的目的是 。
已知:①水浸液的主要成分为 、 及少量可溶性的铜、铅化合物等。
(3)写出三颈烧瓶里发生反应的化学方程式为 。
② 为两性氧化物,微溶于水。
(4)“一系列操作”含有过滤操作,该操作所需要的硅酸盐仪器有 。
③亚硒酸为二元弱酸,
Ⅱ.氯金酸晶体的热分解
研究表明HAuCl •4H O(Mr=412)热分解得到Au的过程可分为四步,某实验小组取一定质量 回答下列问题:
4 2
(1)基态Se原子价电子排布式为 。
的HAuCl •4H O样品进行热重分析,固体质量损失率( ×100%)随温度变
4 2
(2)“除杂渣”的主要成分为 。
化的曲线如图所示: (3)“中和”时控制pH为4~5,生成 沉淀,若硫酸过量,将导致Te的回收率下降的原因
是 。
(4)“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的pH为2,此时溶液中
。
(5)“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式
。
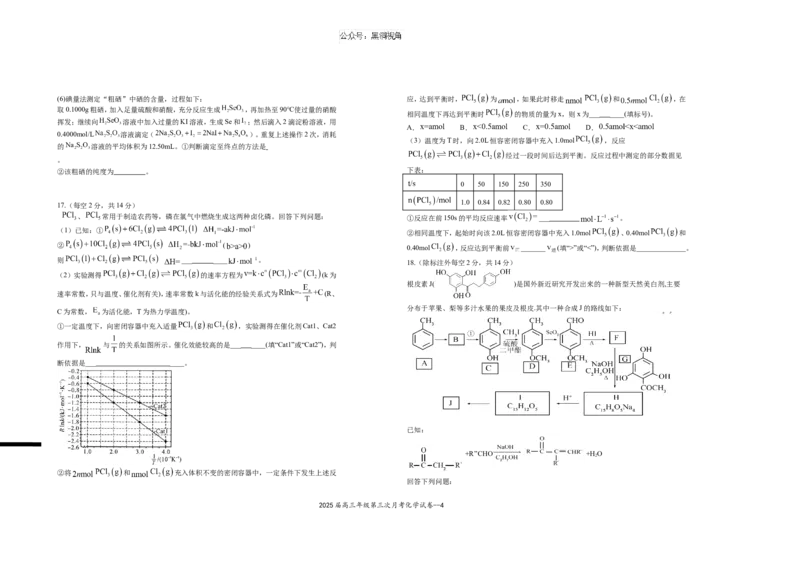
2025届高三年级第三次月考化学试卷--3(6)碘量法测定“粗硒”中硒的含量,过程如下: 应,达到平衡时, 为 ,如果此时移走 和 ,在
取0.1000g粗硒,加入足量硫酸和硝酸,充分反应生成 ,再加热至90℃使过量的硝酸
相同温度下再达到平衡时 的物质的量为x,则x为___ ____(填标号)。
挥发;继续向 溶液中加入过量的KI溶液,生成Se和 ;然后滴入2滴淀粉溶液,用
A. B. C. D.
0.4000mol/L 溶液滴定( )。重复上述操作2次,消耗
(3)温度为T时,向2.0L恒容密闭容器中充入1.0mol ,反应
的 溶液的平均体积为12.50mL。①判断滴定至终点的方法是
经过一段时间后达到平衡。反应过程中测定的部分数据见
。
②该粗硒的纯度为 。 下表:
0 50 150 250 350
1.0 0.84 0.82 0.80 0.80
17.(每空2分,共14分)
、 常用于制造农药等,磷在氯气中燃烧生成这两种卤化磷。回答下列问题: ①反应在前150s的平均反应速率 ___ 。
(1)已知:①
②相同温度下,起始时向该2.0L恒容密闭容器中充入1.0mol 、0.40mol 和
② ( )
0.40mol ,反应达到平衡前 _______ (填“>”或“<”),判断依据是______________。
则 ___ ____ 。
18.(除标注外每空2分,共14分)
(2)实验测得 的速率方程为 (k为
根皮素J( )是国外新近研究开发出来的一种新型天然美白剂,主要
速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为 (R、
分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
C为常数, 为活化能,T为热力学温度)。
①一定温度下,向密闭容器中充入适量 和 ,实验测得在催化剂Cat1、Cat2
作用下, 与 的关系如图所示。催化效能较高的是___ ____(填“Cat1”或“Cat2”),判
断依据是___ ____。
已知:
+R’’CHO +H O
2
②将 和 充入体积不变的密闭容器中,一定条件下发生上述反
回答下列问题:
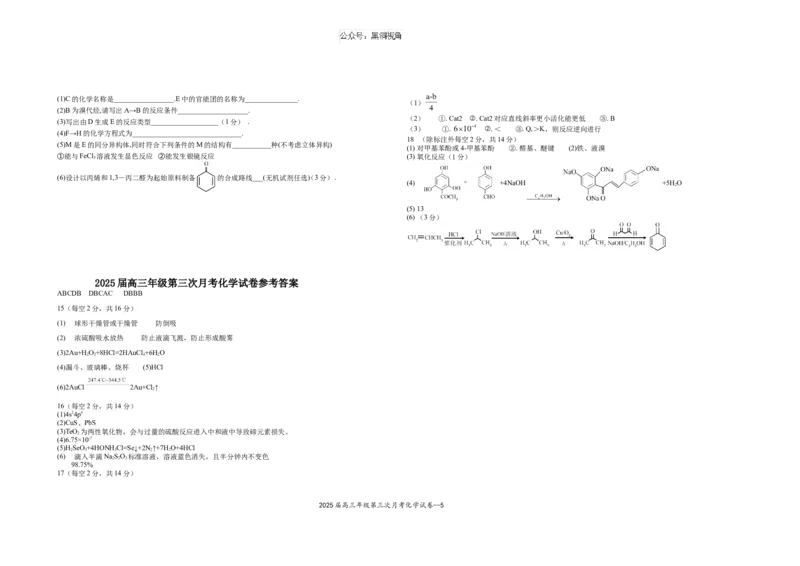
2025届高三年级第三次月考化学试卷--4(1)C的化学名称是_________________.E中的官能团的名称为_______________.
(1)
(2)B为溴代烃,请写出A→B的反应条件____________________.
(2) ①. Cat2 ②. Cat2对应直线斜率更小活化能更低 ③. B
(3)写出由D生成E的反应类型___________________(1分) .
(3) ①. ②. < ③. Q>K,则反应逆向进行
(4)F→H的化学方程式为_______________________________. c
18 (除标注外每空2分,共14分)
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
(1) 对甲基苯酚或4-甲基苯酚 ②. 醛基、醚键 (2)铁、液溴
①能与FeCl 溶液发生显色反应 ②能发生银镜反应 (3) 氧化反应(1分)
3
(6)设计以丙烯和1,3-丙二醛为起始原料制备 的合成路线___(无机试剂任选() 3分) .
(4) +4NaOH +5H O
2
(5) 13
(6) (3分)
2025届高三年级第三次月考化学试卷参考答案
ABCDB DBCAC DBBB
15(每空2分,共16分)
(1) 球形干燥管或干燥管 防倒吸
(2) 浓硫酸吸水放热 防止液滴飞溅,防止形成酸雾
(3)2Au+H O+8HCl=2HAuCl +6H O
2 2 4 2
(4)漏斗、玻璃棒、烧杯 (5)HCl
(6)2AuCl 2Au+Cl ↑
2
16(每空2分,共14分)
(1)4s24p4
(2)CuS、PbS
(3)TeO 为两性氧化物,会与过量的硫酸反应进入中和液中导致碲元素损失。
2
(4)6.75×10-7
(5)H SeO+4HONH Cl=Se↓+2N↑+7H O+4HCl
2 3 3 2 2
(6) 滴入半滴NaSO 标准溶液,溶液蓝色消失,且半分钟内不变色
2 2 3
98.75%
17(每空2分,共14分)
2025届高三年级第三次月考化学试卷--5