文档内容
2019年长春中考化学
1.可用到的相对原子质量:0-16:K-39;Mn-55;C1-35.52.常见金属活动顺序表
3.部分酸、碱、盐的溶解性表(室温)
一、选择题
1.空气的成分中,约占总体积21%的气体是
A.氮气B.氧气C.稀有气体D.二氧化碳
【答案】:B
【解析】:氧气约占空气总体积的21%。
2.下列变化过程中,只发生物理变化的是
A.木炭燃烧B.食物腐烂C.动物呼吸D.水结成冰
【答案】:D
【解析】:物质三态变化属于物理变化。
3.下列由原子构成的物质是
A.金刚石B.氯化钠C.氢气D.水
【答案】:A
【解析】:金刚石是由碳原子构成的。
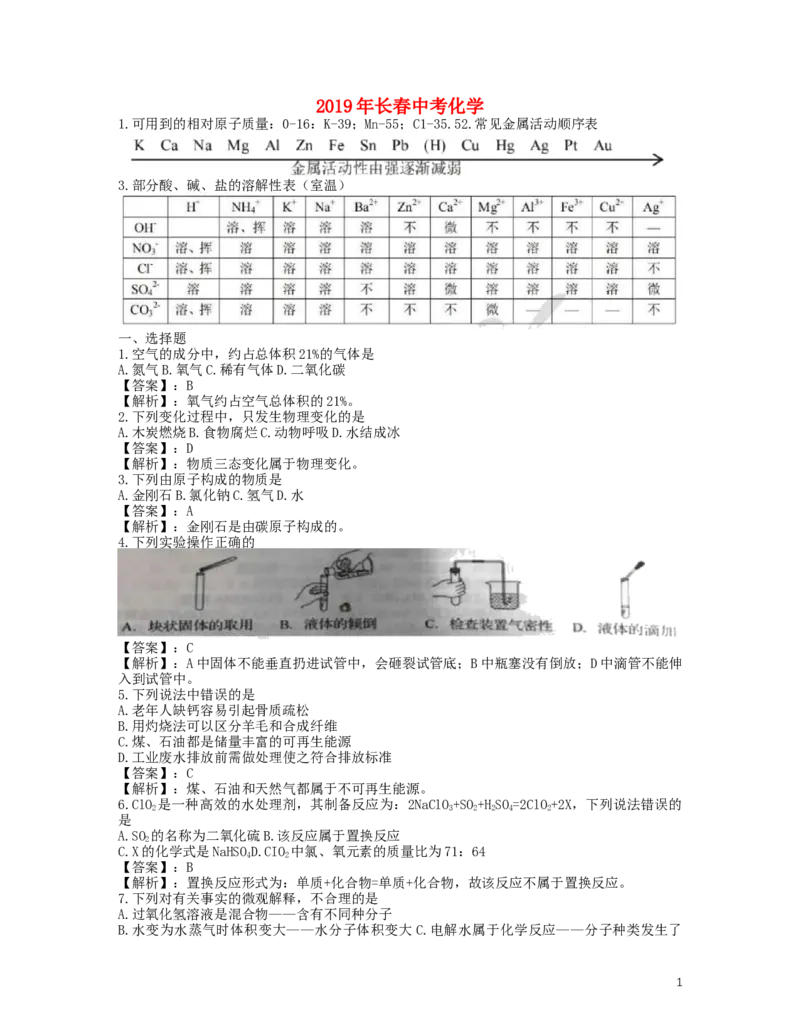
4.下列实验操作正确的
【答案】:C
【解析】:A中固体不能垂直扔进试管中,会砸裂试管底;B中瓶塞没有倒放;D中滴管不能伸
入到试管中。
5.下列说法中错误的是
A.老年人缺钙容易引起骨质疏松
B.用灼烧法可以区分羊毛和合成纤维
C.煤、石油都是储量丰富的可再生能源
D.工业废水排放前需做处理使之符合排放标准
【答案】:C
【解析】:煤、石油和天然气都属于不可再生能源。
6.ClO 是一种高效的水处理剂,其制备反应为:2NaClO+SO+HSO=2ClO+2X,下列说法错误的
2 3 2 2 4 2
是
A.SO 的名称为二氧化硫B.该反应属于置换反应
2
C.X的化学式是NaHSOD.CIO 中氯、氧元素的质量比为71:64
4 2
【答案】:B
【解析】:置换反应形式为:单质+化合物=单质+化合物,故该反应不属于置换反应。
7.下列对有关事实的微观解释,不合理的是
A.过氧化氢溶液是混合物——含有不同种分子
B.水变为水蒸气时体积变大——水分子体积变大C.电解水属于化学反应——分子种类发生了
1改变
D.水与过氧化氢的化学性质不同——分子构成不同
【答案】:B
【解析】:水变成水蒸气体积变大是因为水分子间的间隔变大。
8.下列有关物质用途的说法中正确的是
A.KNO、NHCI都能用作化肥B.NaOH、CaO都能用作食品干燥剂
3 4
C.N、O 都能用作焊接金属的保护气D.NaHCO、Ca(OH) 都能用于治疗胃酸过多症
2 2 3 2
【答案】:A
【解析】:B中NaOH有强腐蚀性,不能作食品干燥剂;C中O 有助燃性,不能作焊接金属的保
2
护气:D中Ca(OH) 不能用于治疗胃酸过多症。
2
9.下列说法中正确的是
A.有发光放热现象的变化一定是燃烧B.pH小于7的降雨一定是酸雨
C.由同种元素组成的纯净物一定是单质D.生成盐和水的反应一定是中和反应
【答案】:C
【解析】:日光灯通电时有发光放热现象,但不是燃烧,故 A错误;pH小于5.6的降雨属于酸
雨,故B错误;金属氧化物与酸的反应以及非金属氧化物与碱的反应也生成盐和水,故D错误。
10.下列实验中,能达到相应目的的是
A.分离CaO和CaCO:将固体混合物高温煅烧
3
B.制备CaCO:向CaCl 溶液中通入足量的CO,过滤C.验证质量守恒定律:将锌粒与稀硫酸混
3 ₂ 2
合,比较混合前后溶液的质量D.除去CO 中混有的HCI和水蒸气:将气体依次通过足量的饱和
2
NaHCO 溶液和浓硫酸
3
【答案】:D
【解析】:A实验后只得到Ca0,故A错误;B中CaCl 溶液和CO 不能发生反应,故B错误;C
2 2
中锌粒和稀硫酸反应生成氢气,不能验证质量守恒定律,故C错误。
二、非选择题
11.回答下列问题
(1)氢元素的符号是;
(2)3个钠离子可用符号表示为;
(3)水的化学式为;
【答案】:(1)H(2)3Na+(3)HO
2
12.根据下图信息,回答下列问题:
(1)据图1可知,溴原子的质子数为:
(2)溴原子在化学反应中容易(选填“得到”或“失去”)电子形成溴离子:
(3)图2甲,与浸从于化字性厕相似的尿于定(子)。
【答案】:(1)35(2)得到(3)C
【解析】:(1)图1元素周期表中左上角的数字为原子序数,原子序数等于质子数;
(2)最外层电子数大于等于4的原子在化学变化中容易得到电子;
(3)最外层电子数相同的原子化学性质相似。
13.回答下列与水有关的问题:
(1)在实验室配置溶液时,常用蒸馏水做;
(2)自来水厂常利用的吸附性除去水中异味;
(3)氢气在氧气中燃烧生成水,能验证水是由组成的
【答案】:(1)溶剂(2)活性炭(3)氢元素和氧元素14.结合下图所示实验,回答有关问
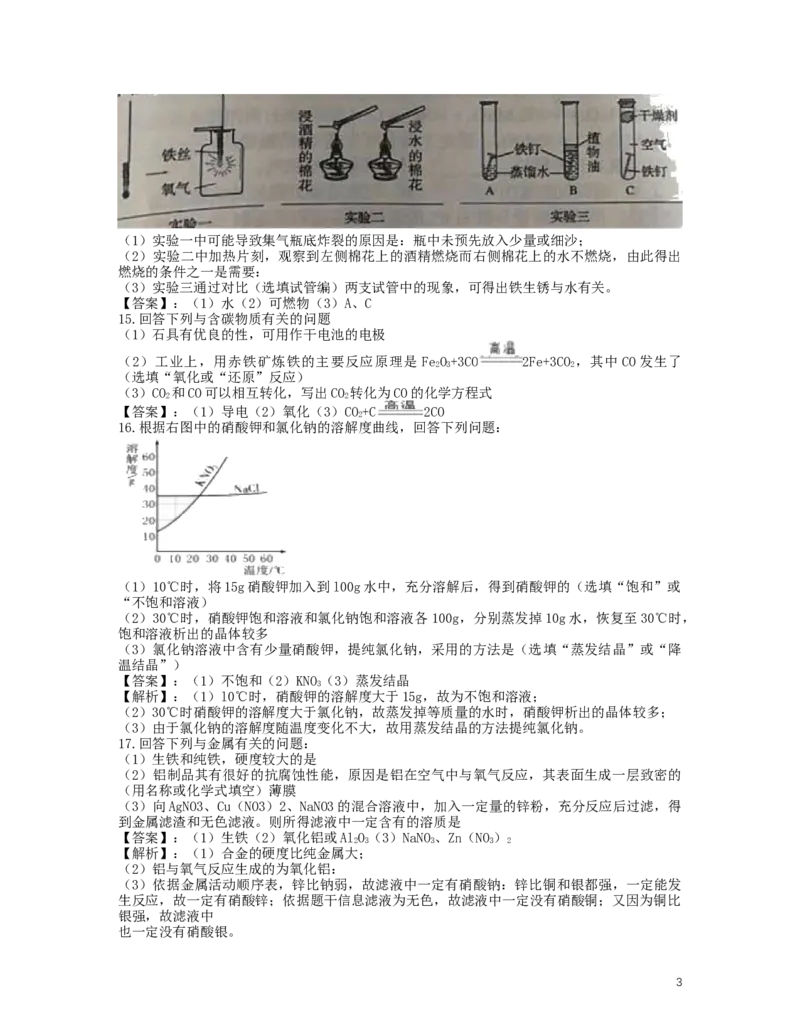
题:
2(1)实验一中可能导致集气瓶底炸裂的原因是:瓶中未预先放入少量或细沙;
(2)实验二中加热片刻,观察到左侧棉花上的酒精燃烧而右侧棉花上的水不燃烧,由此得出
燃烧的条件之一是需要:
(3)实验三通过对比(选填试管编)两支试管中的现象,可得出铁生锈与水有关。
【答案】:(1)水(2)可燃物(3)A、C
15.回答下列与含碳物质有关的问题
(1)石具有优良的性,可用作干电池的电极
(2)工业上,用赤铁矿炼铁的主要反应原理是 FeO+3CO 2Fe+3CO ,其中CO发生了
2 3 2
(选填“氧化或“还原”反应)
(3)CO 和CO可以相互转化,写出CO 转化为CO的化学方程式
2 2
【答案】:(1)导电(2)氧化(3)CO+C 2CO
2
16.根据右图中的硝酸钾和氯化钠的溶解度曲线,回答下列问题:
(1)10℃时,将15g硝酸钾加入到l00g水中,充分溶解后,得到硝酸钾的(选填“饱和”或
“不饱和溶液)
(2)30℃时,硝酸钾饱和溶液和氯化钠饱和溶液各100g,分别蒸发掉10g水,恢复至30℃时,
饱和溶液析出的晶体较多
(3)氯化钠溶液中含有少量硝酸钾,提纯氯化钠,采用的方法是(选填“蒸发结晶”或“降
温结晶”)
【答案】:(1)不饱和(2)KNO(3)蒸发结晶
3
【解析】:(1)l0℃时,硝酸钾的溶解度大于15g,故为不饱和溶液;
(2)30℃时硝酸钾的溶解度大于氯化钠,故蒸发掉等质量的水时,硝酸钾析出的晶体较多;
(3)由于氯化钠的溶解度随温度变化不大,故用蒸发结晶的方法提纯氯化钠。
17.回答下列与金属有关的问题:
(1)生铁和纯铁,硬度较大的是
(2)铝制品其有很好的抗腐蚀性能,原因是铝在空气中与氧气反应,其表面生成一层致密的
(用名称或化学式填空)薄膜
(3)向AgNO3、Cu(NO3)2、NaNO3的混合溶液中,加入一定量的锌粉,充分反应后过滤,得
到金属滤渣和无色滤液。则所得滤液中一定含有的溶质是
【答案】:(1)生铁(2)氧化铝或AlO(3)NaNO、Zn(NO)
2 3 3 3 2
【解析】:(1)合金的硬度比纯金属大;
(2)铝与氧气反应生成的为氧化铝:
(3)依据金属活动顺序表,锌比钠弱,故滤液中一定有硝酸钠:锌比铜和银都强,一定能发
生反应,故一定有硝酸锌;依据题干信息滤液为无色,故滤液中一定没有硝酸铜;又因为铜比
银强,故滤液中
也一定没有硝酸银。
318.下列实验药品常用于实验室制取气体,回答下列问题
(1)标号为F的仪器名称是
(2)用大理石和稀盐酸反应制取CO,并用向上排空气法收集。
2
①组装制取装置时,可选用上图中的A、H、1、J、L、P和
②检验CO 是否收集满的操作是
2
(3)用 制取氧气,并用排水法收集
①加热31.6gKMnO 理论上最多可以生成氧气的质量为g
4
②当观察到导管口时,开始收集氧气
A.刚有气泡放出B.气泡连续并均匀地发出
【答案】:(1)酒精灯(2)①B、C②将燃着的小木条放在集气瓶口(3)①3.2②B
19.在实验室,用溶质质量分数为6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,
回答下列问题(1)需溶质质量分数为6%的氯化钠溶液g
(2)若用量筒量取水时仰视读数,而其它操作均正确,则所得溶液中溶质质量分数(选填
“大于”“小于”或“等于”)3%
(3)混匀时用到的玻璃仪器由烧杯、
【答案】:(1)25(2)小于(3)玻璃棒
【解析】:(1)根据配制过程中溶质的质量不变列方程可得出需溶质质量分数为6%的氯化钠
溶液为25g:
(2)量筒量取水时仰视读数,结果是水取多了,故溶质的质量分数偏小;
(3)混匀需要的仪器为烧杯和玻璃棒。
20研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)
回答下列问题:
(1)SO 和HSO 的化合价均为
3 2 4
(2)反应④为化合反应,该反应的化学方程式为
(3)根据图示判断,下列说法正确的是
A.雾霾的形成只与燃料的燃烧直接产生的颗粒物有关B.使用清洁燃料,减少SO 和NO 的排放,
2 2
有利于减少雾霾的产生
【答案】:(1)+6(2)HSO+2NH3=(NH)SO(3)B
2 4 4 2 4
21.通过如下实验对稀硫酸部分化学性质进行验证,回答下列问题实验一:Mg和稀硫酸实验二:
MgO和稀硫酸实验三:Ba(NO ) 溶液和稀硫酸实验四:KOH溶液和稀硫酸(1)实验三中发生
3 2
反应的化学方程式为
(2)实验四无明显现象,再将打磨过的铁丝浸入该试验后的溶液中,仍无明显现象,据此
(选填“能”或“不能”)验证KOH溶液和H SO 发生反应
₂ 4
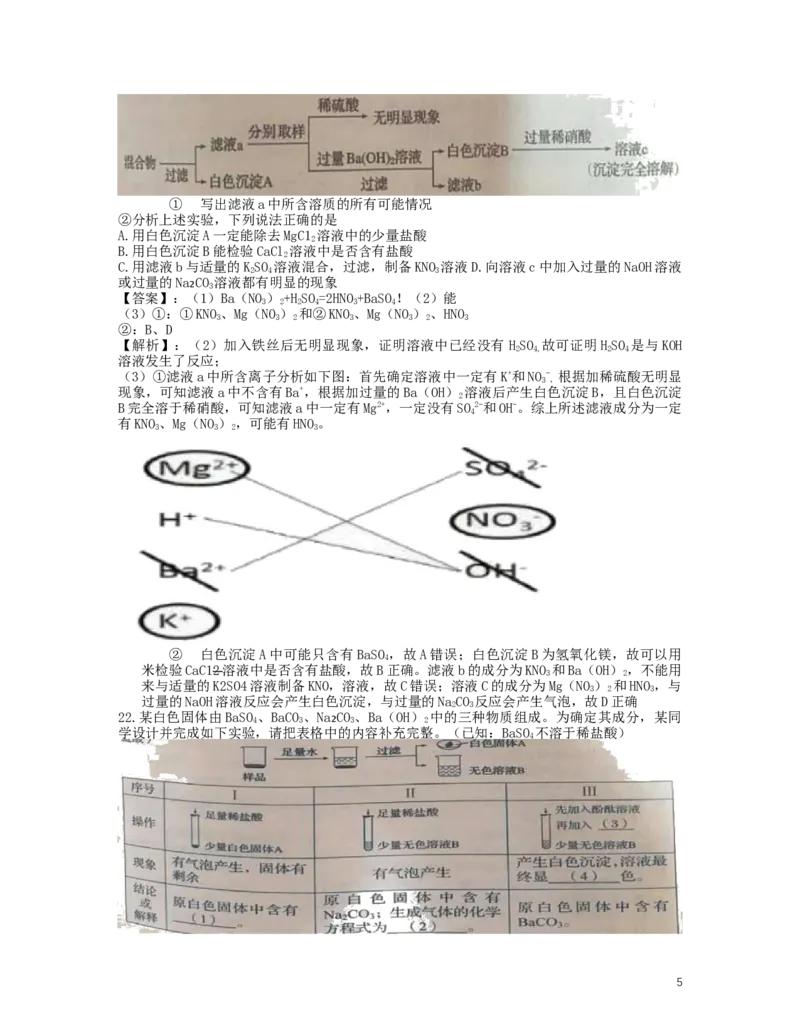
(3)将上述所有实验后的溶液混合,并进行如下实验:
4① 写出滤液a中所含溶质的所有可能情况
②分析上述实验,下列说法正确的是
A.用白色沉淀A一定能除去MgC1 溶液中的少量盐酸
2
B.用白色沉淀B能检验CaCl 溶液中是否含有盐酸
2
C.用滤液b与适量的KSO 溶液混合,过滤,制备KNO 溶液D.向溶液c中加入过量的NaOH溶液
2 4 3
或过量的Na CO 溶液都有明显的现象
₂ 3
【答案】:(1)Ba(NO)+HSO=2HNO+BaSO!(2)能
3 2 2 4 3 4
(3)①:①KNO、Mg(NO) 和②KNO、Mg(NO)、HNO
3 3 2 3 3 2 3
②:B、D
【解析】:(2)加入铁丝后无明显现象,证明溶液中已经没有 HSO 故可证明HSO 是与KOH
2 4, 2 4
溶液发生了反应;
(3)①滤液a中所含离子分析如下图:首先确定溶液中一定有K+和NO- 根据加稀硫酸无明显
3 ,
现象,可知滤液a中不含有Ba+,根据加过量的Ba(OH) 溶液后产生白色沉淀B,且白色沉淀
2
B完全溶于稀硝酸,可知滤液a中一定有Mg2+,一定没有SO2-和OH-。综上所述滤液成分为一定
4
有KNO、Mg(NO),可能有HNO。
3 3 2 3
② 白色沉淀A中可能只含有BaSO ,故A错误;白色沉淀B为氢氧化镁,故可以用
4
米检验CaC12 溶液中是否含有盐酸,故B正确。滤液b的成分为KNO 和Ba(OH),不能用
3 2
来与适量的K2SO4溶液制备KNO,溶液,故C错误;溶液C的成分为Mg(NO) 和HNO,与
3 2 3
过量的NaOH溶液反应会产生白色沉淀,与过量的NaCO 反应会产生气泡,故D正确
2 3
22.某白色固体由BaSO 、BaCO 、Na CO 、Ba(OH) 中的三种物质组成。为确定其成分,某同
4 3 ₂ 3 2
学设计并完成如下实验,请把表格中的内容补充完整。(已知:BaSO 不溶于稀盐酸)
4
5【答案】:(1)BaSO(2)NaCO+2HC1=2NaCl+H0+CO↑
4 2 3 2 2
(3)过量的CaCl 溶液(4)无色
2
【解析】:(1)BaSO 为不溶于酸的固体,故含有BaSO;
4 4
(3)l实验的目的是为了检验无色溶液B中是否含有OH-,从而证明原白色固体中是否有Ba
(OH) ,所以需要加入过量的CaCl 溶液除去无色溶液B中Na CO 带来的干扰,然后,根据溶
2 2 ₂ 3
液的颜色来判断是否有Ba(OH),若最终溶液为红色,则证明
2
有Ba(OH);若最终溶液为无色,则证明没有Ba(OH),有BaCO。
2 2 3
6