文档内容
辽宁省名校联盟 2024 年高三 3 月份联合考试
化学
本试卷满分100分,考试时间75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。答非选择题时,将答案写在答题卡上。写在本试卷
上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 O 16 Na 23 S 32 Fe 56 Te 127.6
一、选择题:本题共 15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1. 化学与艺术、历史息息相关,下列关于黑、吉、辽、内蒙古四地博物院(馆)藏品的说法错误的是
A. 黑龙江省:“金代铜坐龙”其材质为黄铜,属于合金
B. 吉林省:“错金银丙午神钩”其材质中的金丝、银片,都属于单质
C. 辽宁省:“虢国夫人游春图”绘画基材为绢,属于合成高分子
D. 内蒙古自治区:“元代钧窑鼎式香炉”其内胎由黏土烧结而成,属于硅酸盐材料
【答案】C
【解析】
【详解】A.黄铜是铜锌合金,A正确;
B.金丝、银片都是金属单质,B正确;
C.绢的主要成分是蛋白质,属于天然有机高分子,C错误;
为
D.黏土主要成分 硅酸盐,D正确;
答案选C。
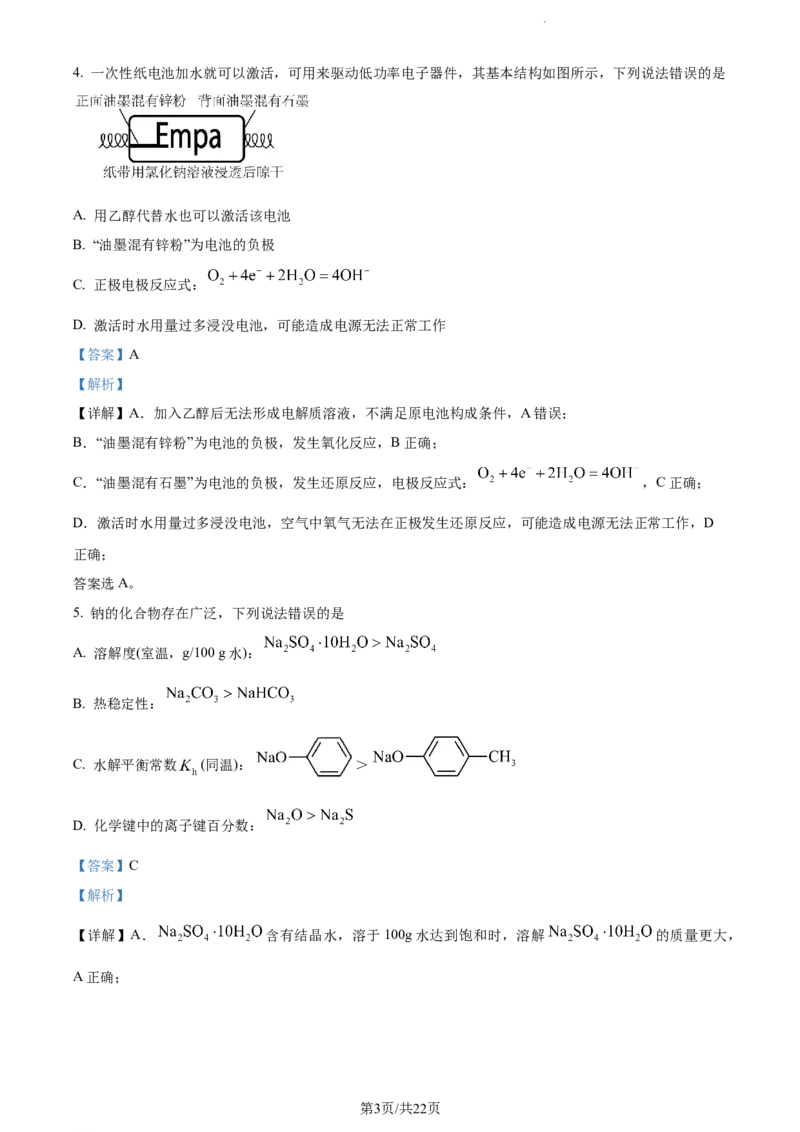
2. 下列化学用语或图示表达正确的是
A. 中子数为8的碳原子: B. CO 的空间填充模型:
2
C. 2p 的电子云轮廓图: D. MgCl 的电子式:
z 2
第1页/共22页
学科网(北京)股份有限公司【答案】C
【解析】
【详解】A.中子数为8的碳原子: ,A错误;
B. 为球棍模型,B错误;
C.2p 的电子云轮廓图: ,C正确;
z
D.MgCl 的电子式: ,D错误;
2
故选C。
3. 下列除杂试剂和方法的选择均正确的是
选项 物质(杂质) 除杂试剂 方法
A 溴苯(溴) 苯酚 过滤
B 乙酸乙酯(乙酸) NaOH溶液 分液
C CO(HCl) 浓硫酸 洗气
2
D 苯甲酸(泥沙,NaCl) 蒸馏水 重结晶
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A.溴和苯酚的反应产物能溶于溴苯中,除去溴苯中的溴,可用氢氧化钠溶液反复洗涤,并用分
液漏斗分离出有机层,故A错误;
B.乙酸乙酯和乙酸均能和氢氧化钠溶液反应,应用饱和碳酸钠溶液,既可以降低乙酸乙酯的溶解,又可
以吸收乙酸将其转化为易溶性的盐,再经过分液即可提纯乙酸乙酯,故B错误;
C.二氧化碳和氯化氢都不能与浓硫酸反应,不能使用浓硫酸进行除杂,除去二氧化碳中的氯化氢应用饱
和碳酸氢钠溶液洗气,故C错误;
D.苯甲酸的溶解度随温度升高而增大,氯化钠的溶解度受温度影响变化不大,可配成热饱和溶液,趁热
过滤,降温结晶,为进一步提纯,可采取重结晶的方法,故D正确;
故答案为:D。
第2页/共22页
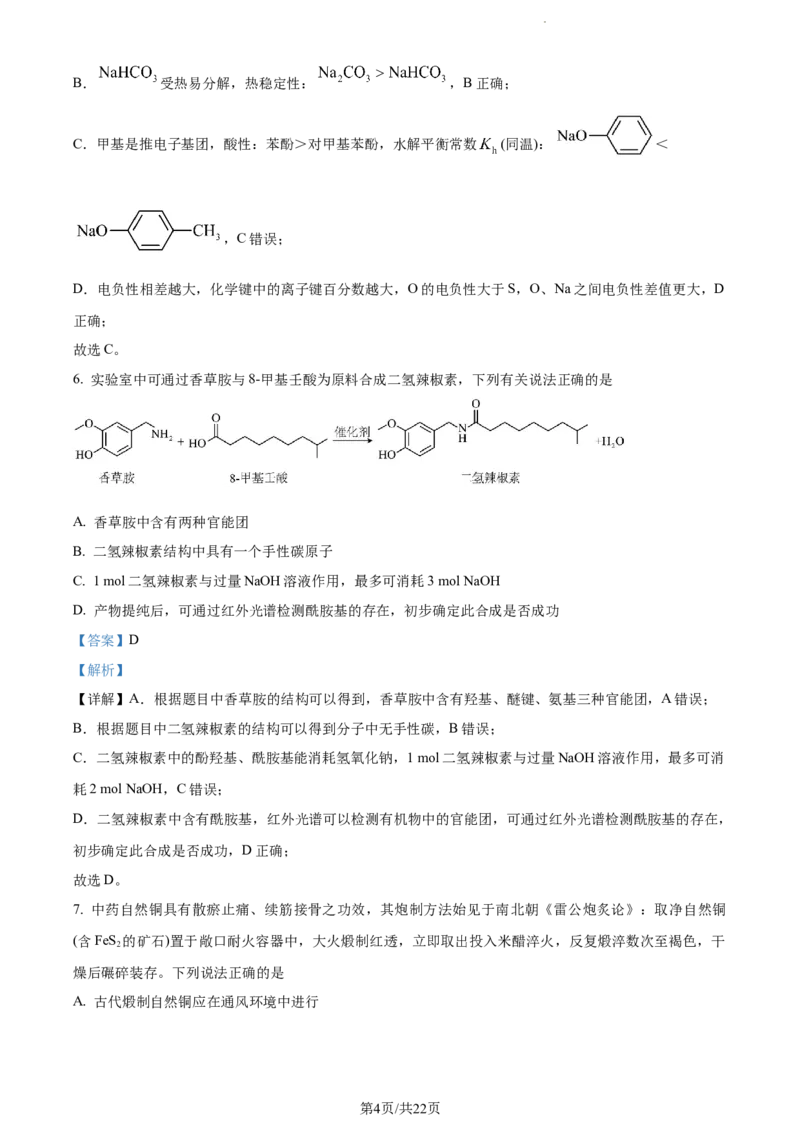
学科网(北京)股份有限公司4. 一次性纸电池加水就可以激活,可用来驱动低功率电子器件,其基本结构如图所示,下列说法错误的是
A. 用乙醇代替水也可以激活该电池
B. “油墨混有锌粉”为电池的负极
C. 正极电极反应式:
D. 激活时水用量过多浸没电池,可能造成电源无法正常工作
【答案】A
【解析】
【详解】A.加入乙醇后无法形成电解质溶液,不满足原电池构成条件,A错误;
B.“油墨混有锌粉”为电池的负极,发生氧化反应,B正确;
C.“油墨混有石墨”为电池的负极,发生还原反应,电极反应式: ,C正确;
D.激活时水用量过多浸没电池,空气中氧气无法在正极发生还原反应,可能造成电源无法正常工作,D
正确;
答案选A。
5. 钠的化合物存在广泛,下列说法错误的是
A. 溶解度(室温,g/100 g水):
B. 热稳定性:
C. 水解平衡常数 (同温): >
D. 化学键中的离子键百分数:
【答案】C
【解析】
【详解】A. 含有结晶水,溶于100g水达到饱和时,溶解 的质量更大,
A正确;
第3页/共22页
学科网(北京)股份有限公司B. 受热易分解,热稳定性: ,B正确;
C.甲基是推电子基团,酸性:苯酚>对甲基苯酚,水解平衡常数 (同温): <
,C错误;
D.电负性相差越大,化学键中的离子键百分数越大,O的电负性大于S,O、Na之间电负性差值更大,D
正确;
故选C。
6. 实验室中可通过香草胺与8-甲基壬酸为原料合成二氢辣椒素,下列有关说法正确的是
A. 香草胺中含有两种官能团
B. 二氢辣椒素结构中具有一个手性碳原子
C. 1 mol二氢辣椒素与过量NaOH溶液作用,最多可消耗3 mol NaOH
D. 产物提纯后,可通过红外光谱检测酰胺基的存在,初步确定此合成是否成功
【答案】D
【解析】
【详解】A.根据题目中香草胺的结构可以得到,香草胺中含有羟基、醚键、氨基三种官能团,A错误;
B.根据题目中二氢辣椒素的结构可以得到分子中无手性碳,B错误;
C.二氢辣椒素中的酚羟基、酰胺基能消耗氢氧化钠,1 mol二氢辣椒素与过量NaOH溶液作用,最多可消
耗2 mol NaOH,C错误;
D.二氢辣椒素中含有酰胺基,红外光谱可以检测有机物中的官能团,可通过红外光谱检测酰胺基的存在,
初步确定此合成是否成功,D正确;
故选D。
7. 中药自然铜具有散瘀止痛、续筋接骨之功效,其炮制方法始见于南北朝《雷公炮炙论》:取净自然铜
(含FeS 的矿石)置于敞口耐火容器中,大火煅制红透,立即取出投入米醋淬火,反复煅淬数次至褐色,干
2
燥后碾碎装存。下列说法正确的是
A. 古代煅制自然铜应在通风环境中进行
第4页/共22页
学科网(北京)股份有限公司B. 煅制过程中1 mol FeS 被完全氧化,转移电子的数目约为
2
C. 自然铜淬火过程中发生反应的离子方程式为
D. 含自然铜成分的中成药大七厘散(处方药),其包装上有“OTC”标识
【答案】A
【解析】
【详解】A.由题干信息可知,古代煅制自然铜时因会产生有毒有害的气体SO ,故应在通风环境中进行,
2
A正确;
B. 锻制过程是FeS 与O 反应生成Fe O 和SO ,即Fe由+2价转化为+3价,S由-1价转化为+4价,故煅制
2 2 2 3 2
过程中1 mol FeS 被完全氧化,转移电子的数目约为 ,B错误;
2
C.自然铜淬火过程中即Fe O 与醋酸反应,故发生反应的离子方程式为
2 3
,C错误;
D.处方药的标识为 “R”,OTC为非处方药的标识,即含自然铜成分的中成药大七厘散(处方药),其包装
上有“R”标识,D错误;
故答案为:A。
8. 肼(N H)是一种应用广泛的化工原料,其结构相当于氨分子中的一个氢原子被氨基取代,因此肼与氨在
2 4
性质上有一定的相似性。下列有关说法中正确的是
A. 肼分子中存在s-p σ键和p-p σ键
B. 肼能够较好地溶于水或乙醇等溶剂
C. 肼存在顺式和反式两种同分异构体: 和
D. 肼能与过量硫酸反应形成酸式盐NHHSO
2 5 4
【答案】B
【解析】
【分析】由题干信息可知,肼(N H)是一种应用广泛的化工原料,其结构相当于氨分子中的一个氢原子被
2 4
氨基取代,则NH 的电子式为: ,据此分析解题。
2 4
第5页/共22页
学科网(北京)股份有限公司【详解】A.由分析可知,肼分子中的N原子采用sp3杂化,故肼分子中存在s-sp3 σ键和sp3-sp3 σ键,A
错误;
的
B.由题干信息可知,肼与氨在性质上有一定 相似性,故肼能够较好地溶于水或乙醇等溶剂,B正确;
的
C.由肼 电子式可知,N原子间单键连接可以任意旋转,故肼不存在顺式和反式两种同分异构体,C错
误;
D.由肼的电子式可知,肼分子中每个N原子上各有一对孤电子对,故肼能与过量硫酸反应形成酸式盐
NHSO ,D错误;
2 6 4
故答案为:B。
9. 氧烛可用于潜艇或密闭空间供氧,由下表中物质压制成形,其原理为受热时,利用d区元素形成的氧化
物催化制氧剂分解产生O 下列说法正确的是
2.
成分 Al Fe KClO BaO SiO、Al O
3 2 2 2 3
燃 烧
作用 产生催化剂 制氧剂 Cl 吸收剂 定型剂
物 2
A. 氧烛供氧时,Al燃烧为KClO 分解提供能量
3
B. 氧烛成分中的Fe也可以用Cu来代替
C. BaO 吸收氯气时发生反应:
2
D. 氧烛燃尽后残留物可以全部溶解在足量氢氧化钠溶液中
【答案】A
【解析】
【详解】A.KClO 分解条件是催化剂、加热,Al燃烧能放出大量热,可为KClO 分解提供能量,A正确;
3 3
B.Cu位于周期表的ds区,不符合形成氧化物催化剂的要求,不可代替Fe,B错误;
C.BaO 中氧元素为-1价,吸收Cl 时,Cl 作氧化剂,被还原生成 ,BaO 中的氧被氧化生成O,反应
2 2 2 2 2
的化学方程式为: ,C错误;
D.氧烛燃烧时,Fe形成氧化物催化剂,Fe的氧化物不溶于NaOH溶液,D错误;
故选A。
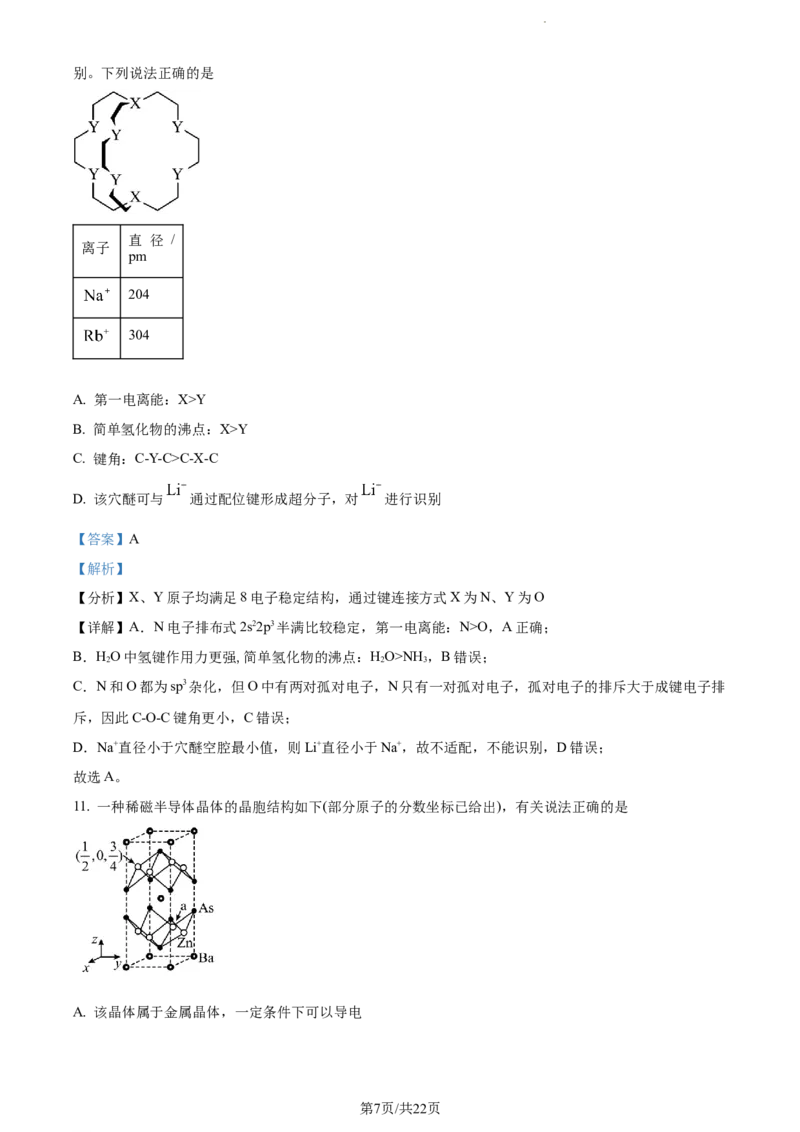
10. 由C、H和与C处于同周期的X、Y四种元素组成的穴醚的键线式如图,该结构中除H外其余原子均满
足8电子稳定结构,其空腔直径大约为260~320 pm,可以适配直径与之相近的碱金属离子从而实现离子识
第6页/共22页
学科网(北京)股份有限公司别。下列说法正确的是
直 径 /
离子
pm
204
304
A. 第一电离能:X>Y
B. 简单氢化物的沸点:X>Y
C. 键角:C-Y-C>C-X-C
D. 该穴醚可与 通过配位键形成超分子,对 进行识别
【答案】A
【解析】
【分析】X、Y原子均满足8电子稳定结构,通过键连接方式X为N、Y为O
【详解】A.N电子排布式2s22p3半满比较稳定,第一电离能:N>O,A正确;
B.HO中氢键作用力更强,简单氢化物的沸点:HO>NH ,B错误;
2 2 3
C.N和O都为sp3杂化,但O中有两对孤对电子,N只有一对孤对电子,孤对电子的排斥大于成键电子排
斥,因此C-O-C键角更小,C错误;
D.Na+直径小于穴醚空腔最小值,则Li+直径小于Na+,故不适配,不能识别,D错误;
故选A。
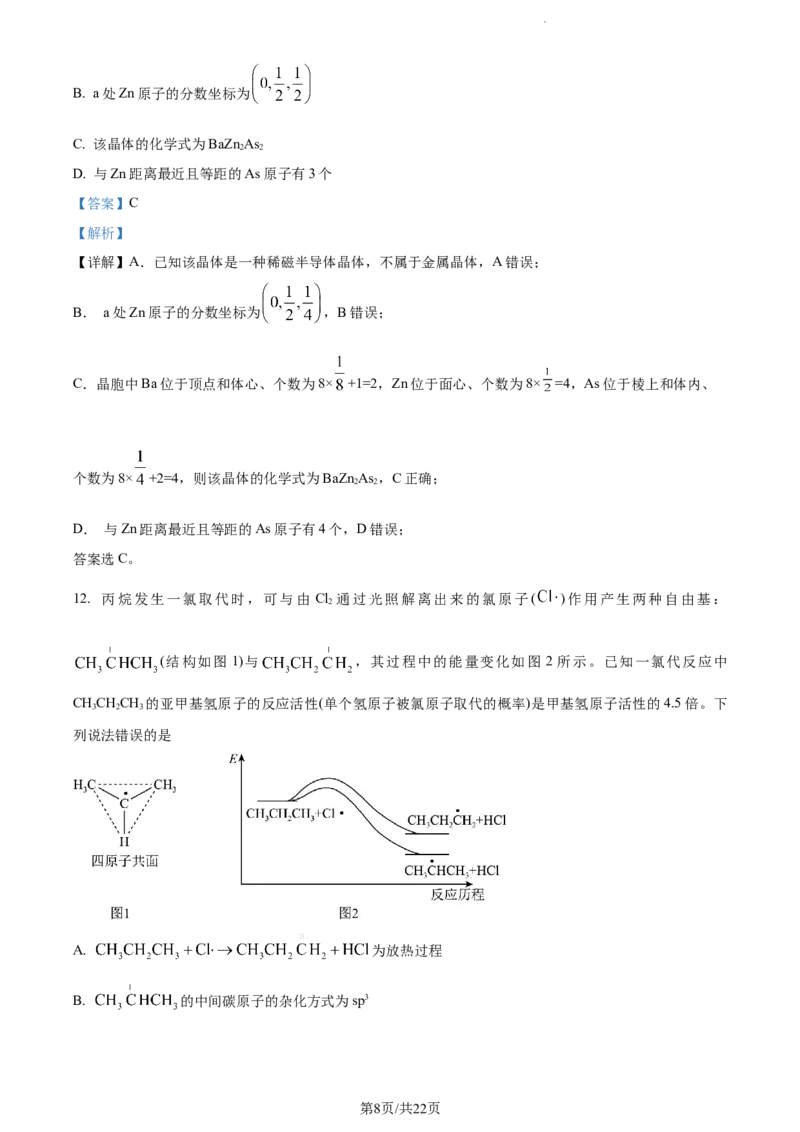
11. 一种稀磁半导体晶体的晶胞结构如下(部分原子的分数坐标已给出),有关说法正确的是
A. 该晶体属于金属晶体,一定条件下可以导电
第7页/共22页
学科网(北京)股份有限公司B. a处Zn原子的分数坐标为
C. 该晶体的化学式为BaZn As
2 2
D. 与Zn距离最近且等距的As原子有3个
【答案】C
【解析】
【详解】A.已知该晶体是一种稀磁半导体晶体,不属于金属晶体,A错误;
B. a处Zn原子的分数坐标为 ,B错误;
C.晶胞中Ba位于顶点和体心、个数为8× +1=2,Zn位于面心、个数为8× =4,As位于棱上和体内、
个数为8× +2=4,则该晶体的化学式为BaZn As ,C正确;
2 2
D. 与Zn距离最近且等距的As原子有4个,D错误;
答案选C。
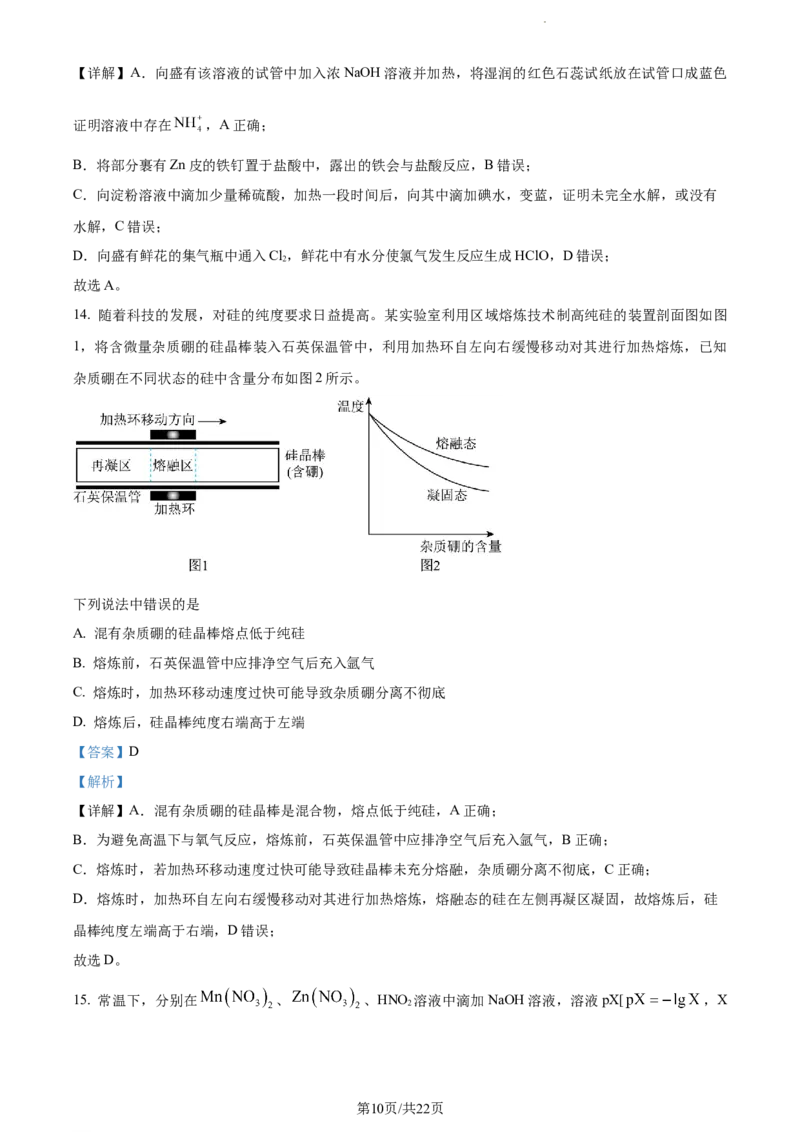
12. 丙烷发生一氯取代时,可与由 Cl 通过光照解离出来的氯原子( )作用产生两种自由基:
2
(结构如图 1)与 ,其过程中的能量变化如图 2 所示。已知一氯代反应中
CHCHCH 的亚甲基氢原子的反应活性(单个氢原子被氯原子取代的概率)是甲基氢原子活性的4.5倍。下
3 2 3
列说法错误的是
A. 为放热过程
B. 的中间碳原子的杂化方式为sp3
第8页/共22页
学科网(北京)股份有限公司C. 稳定性:
D. 设丙烷一氯取代时无副反应发生,则1-氯丙烷在有机产物中的物质的量百分数为40%
【答案】B
【解析】
【详解】A.从图中可以看出,反应 的生成物能量比反应物
低,则该反应为放热过程,A正确;
B.图1信息显示, 的中间碳原子和与它相连的原子共面,则中间碳原子发生的杂化方式为
sp2,B错误;
C.图2信息显示, 的能量比 低,则稳定性: ,
C正确;
D.已知一氯代反应中CHCHCH 的亚甲基氢原子的反应活性(单个氢原子被氯原子取代的概率)是甲基氢
3 2 3
原子活性的4.5倍。设丙烷一氯取代时无副反应发生,则1-氯丙烷在有机产物中的物质的量百分数为
=40%,D正确;
故选B。
13. 下列实验方案能达到实验目的的是
选
实验目的 实验方案
项
向盛有该溶液的试管中加入浓NaOH溶液并加热,将湿润的红色石
A 检验溶液中是否存在
蕊试纸放在试管口
检验牺牲阳极法保护金属Fe 将部分裹有Zn皮的铁钉置于盐酸中,向其中滴加 溶
B
的效果
液
C 检验淀粉是否水解 向淀粉溶液中滴加少量稀硫酸,加热一段时间后,向其中滴加碘水
D 检验氯气是否具有漂白性 向盛有鲜花的集气瓶中通入Cl,观察鲜花颜色的变化
2
A. A B. B C. C D. D
【答案】A
【解析】
第9页/共22页
学科网(北京)股份有限公司【详解】A.向盛有该溶液的试管中加入浓NaOH溶液并加热,将湿润的红色石蕊试纸放在试管口成蓝色
证明溶液中存在 ,A正确;
B.将部分裹有Zn皮的铁钉置于盐酸中,露出的铁会与盐酸反应,B错误;
C.向淀粉溶液中滴加少量稀硫酸,加热一段时间后,向其中滴加碘水,变蓝,证明未完全水解,或没有
水解,C错误;
D.向盛有鲜花的集气瓶中通入Cl,鲜花中有水分使氯气发生反应生成HClO,D错误;
2
故选A。
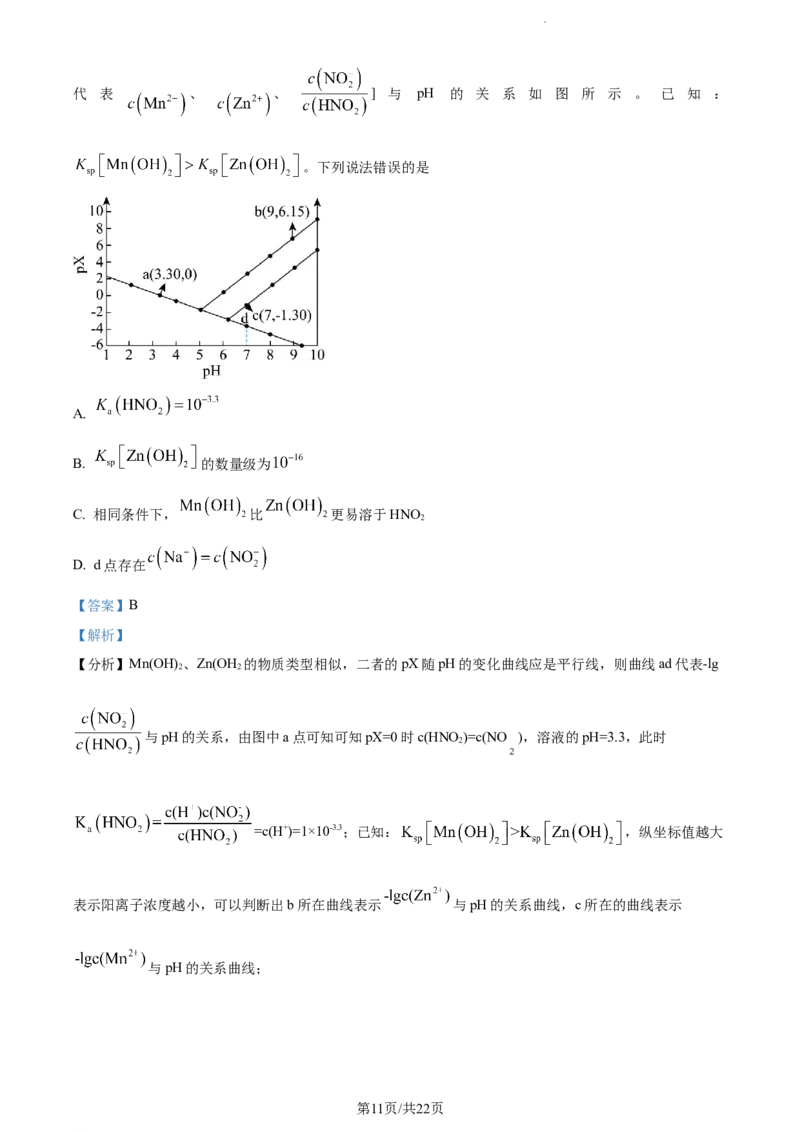
14. 随着科技的发展,对硅的纯度要求日益提高。某实验室利用区域熔炼技术制高纯硅的装置剖面图如图
1,将含微量杂质硼的硅晶棒装入石英保温管中,利用加热环自左向右缓慢移动对其进行加热熔炼,已知
杂质硼在不同状态的硅中含量分布如图2所示。
下列说法中错误的是
A. 混有杂质硼的硅晶棒熔点低于纯硅
B. 熔炼前,石英保温管中应排净空气后充入氩气
C. 熔炼时,加热环移动速度过快可能导致杂质硼分离不彻底
D. 熔炼后,硅晶棒纯度右端高于左端
【答案】D
【解析】
【详解】A.混有杂质硼的硅晶棒是混合物,熔点低于纯硅,A正确;
B.为避免高温下与氧气反应,熔炼前,石英保温管中应排净空气后充入氩气,B正确;
C.熔炼时,若加热环移动速度过快可能导致硅晶棒未充分熔融,杂质硼分离不彻底,C正确;
D.熔炼时,加热环自左向右缓慢移动对其进行加热熔炼,熔融态的硅在左侧再凝区凝固,故熔炼后,硅
晶棒纯度左端高于右端,D错误;
故选D。
15. 常温下,分别在 、 、HNO 溶液中滴加NaOH溶液,溶液pX[ ,X
2
第10页/共22页
学科网(北京)股份有限公司代 表 、 、 ] 与 pH 的 关 系 如 图 所 示 。 已 知 :
。下列说法错误的是
A.
B. 的数量级为
C. 相同条件下, 比 更易溶于HNO
2
D. d点存在
【答案】B
【解析】
【分析】Mn(OH) 、Zn(OH 的物质类型相似,二者的pX随pH的变化曲线应是平行线,则曲线ad代表-lg
2 2
与pH的关系,由图中a点可知可知pX=0时c(HNO )=c(NO ),溶液的pH=3.3,此时
2
=c(H+)=1×10-3.3;已知: ,纵坐标值越大
表示阳离子浓度越小,可以判断出b所在曲线表示 与pH的关系曲线,c所在的曲线表示
与pH的关系曲线;
第11页/共22页
学科网(北京)股份有限公司【详解】A.由上述分析可知, ,故A正确;
B.b所在曲线表示 与pH的关系曲线,根据b点的坐标值,此时c(Zn2+)=1×10-6.15,
c(OH-)=1×10-5, = = = ,数量级为 ,故
B错误;
C.已知: ,即当c(H+)相同时,c(Mn2+)的浓度更大,故,
比 更易溶于HNO,故C正确;
2
D.d点溶液呈中性,电荷守恒等式为: ,根据
可得 ,故D正确。
答案选B。
二、非选择题:本题共4小题,共55分。
16. 碲化镉(CdTe)量子点具有优异的光电性能。某科研人员设计以电解精炼铜获得的富碲渣(含铜、碲、银
等)为原料合成碲化镉量子点的流程如下:
回答下列问题:
(1)电解精炼铜时原料富碲渣将在___________(填“阴”或“阳”)极区获得。
(2)“硫酸酸浸”时,取含单质Te 6.38%的富碲渣20 g,为将Te全部溶出转化为 ,需加质量分
数为30%的HO(密度:1.134 g/cm3)___________mL。但实际操作中,HO 用量远高于该计算值,原因之
2 2 2 2
一是Cu同时也被HO 浸出,请写出Cu被浸出时发生反应的离子方程式:___________。
2 2
(3)化学中用标准电极电势 (氧化态/还原态)反映微粒间得失电子能力的强弱,一般这个数值越大,氧
化态转化为还原态越容易。已知硫酸酸浸液中部分微粒的标准还原电极电势为 、
第12页/共22页
学科网(北京)股份有限公司,则SO “还原”酸浸液时,主要发生反应的化学方程式是___________。
2
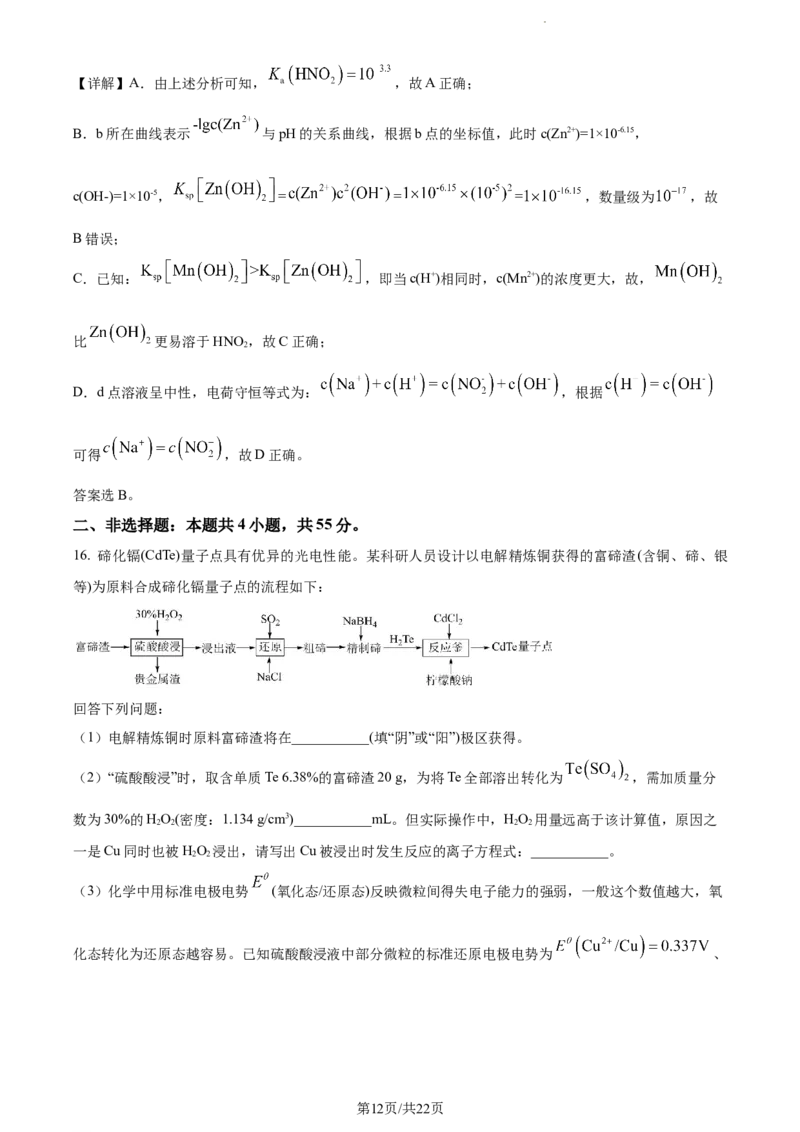
(4)①在研究“还原”步骤实验条件时,发现Te、Cu单位时间内沉淀率随NaCl溶液浓度的变化如图所示,
则该步骤应选择的NaCl溶液适宜浓度为___________。
②结合下列反应机理(反应中水及部分产物已省略),推测NaCl在“还原”步骤中的作用是___________。
(5)①合成量子点时,加入柠檬酸钠作为包覆剂,利用柠檬酸钠的憎水基团修饰CdTe,亲水基团则用于
增强其生物相容性,下列最可能替代柠檬酸钠生产具备以上特征量子点的物质是___________(填字母)。
A.硬脂酸钠 B.甲苯 C.乙酸乙酯 D.碳酸钠
②量子点在微观尺寸发生变化时,可以在特定波长的激光照射下发出不同颜色的光,关于这一现象下列说
法正确的是___________(填字母)。
A.属于物理变化 B.属于化学变化 C.由光化学反应产生 D.由电子跃迁形成
【答案】(1)阳 (2) ①. 4.9 ②. Cu+ HO+2H+=Cu2++2H O
2 2 2
(3)
(4) ①. 30g/L ②. 作催化剂
(5) ①. A ②. AD
【解析】
【分析】富碲渣经过硫酸酸浸后,Te转化为Te(SO ) ,过滤后的浸出液经过二氧化硫还原得到粗碲,粗碲
4 2
处理后得到精制碲,与NaBH 反应得到HTe,在反应釜中与CdCl 在柠檬酸钠作用下反应得到CdTe量子
4 2 2
点。
【小问1详解】
电解精炼铜得到富碲渣,其中含贵金属,电解精炼铜时阳极产生阳极泥,含贵金属,故应在阳极区得到;
第13页/共22页
学科网(北京)股份有限公司【小问2详解】
反应中Te转化为Te(SO ),HO 转化为HO,根据得失电子守恒,可找出关系式: ,故消耗
4 2 2 2 2
的HO 的体积为: ;Cu被浸出时发生反应的离子方程式:Cu+
2 2
HO+2H+=Cu2++2H O;
2 2 2
【小问3详解】
根据题意,标准电极电势 数值越大,氧化态转化为还原态越容易,故SO “还原”酸浸液时,主要发生反
2
应的化学方程式是: ;
【小问4详解】
①当NaCl溶液浓度为30g/L时Te的沉淀率高而Cu的沉淀率低,该步骤应选择的NaCl溶液适宜浓度为:
30g/L;
②根据反应机理图,氯离子参与反应,最终又生成,推测NaCl在“还原”步骤中的作用是作催化剂;
【小问5详解】
①根据题干信息,合成量子点时选择的包覆剂应含亲水基和憎水基,硬脂酸钠含憎水基烃基,含亲水基羧
基,故选A;甲苯和乙酸乙酯只含憎水基,碳酸钠只含亲水基,不符合题意;
②量子点在微观尺寸发生变化时,可以在特定波长的激光照射下发出不同颜色的光,这种现象是发生了电
子的跃迁,属于物理变化,故选AD。
17. 氧 桥 三 核 铁 (Ⅲ) 配 合 物 是 一 种 结 构 新 颖 、 性 质 优 异 的 配 合 物 , 其 化 学 式 为
,是一种红棕色晶体。其制备、元素分析及结构研究如下:
(一)晶体制备:
将硝酸铁固体在80℃加热条件下溶于去离子水得到溶液,将此溶液逐滴滴入乙酸钠溶液中,充分反应,室
温充分冷却、抽滤、洗涤、转移、烘干、称量并记录。
资料显示:硝酸铁固体在溶于水时部分水解、缩合成一种重要的中间体 。
(1)硝酸铁固体溶解时可以选用的加热方式是___________,加热的目的是___________。
(2)试写出由 生成中间体的离子方程式:___________。
第14页/共22页
学科网(北京)股份有限公司(二)铁含量测定:
准确称取a g产品配制成250 mL溶液,取25.00 mL溶液于锥形瓶中,加入盐酸酸化使配合物酸解为 ,
再加入2滴磺基水杨酸钠(NaH SSA)指示剂,用c mol/L EDTA二钠盐( )溶液滴定至终点,重复三次,
2
平均消耗EDTA二钠盐溶液的体积为V mL。已知滴定过程中发生的反应如下:
;
。
(3)该测定实验无需使用的实验仪器有___________(填序号)。
(4)滴定终点的现象是___________。
(5)产品中铁元素的含量是___________(用含a、c、V的符号表示并化成百分数)。
(三)结构研究:
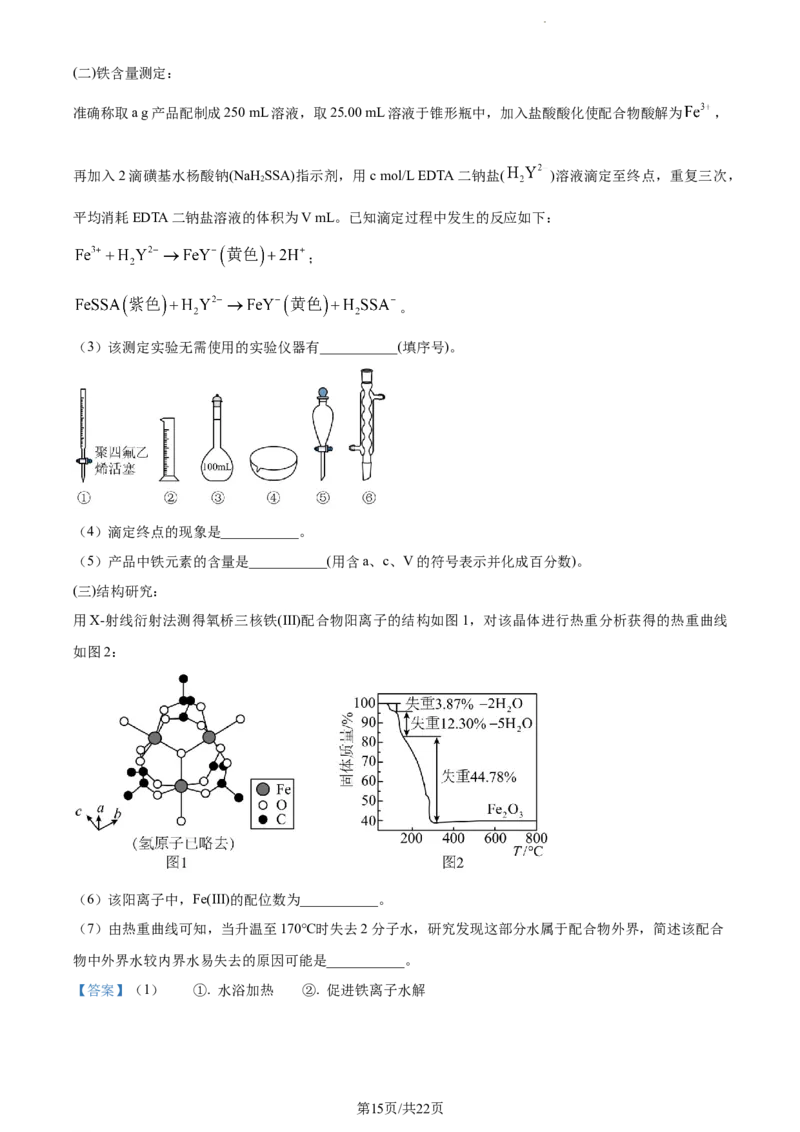
用X-射线衍射法测得氧桥三核铁(Ⅲ)配合物阳离子的结构如图1,对该晶体进行热重分析获得的热重曲线
如图2:
(6)该阳离子中,Fe(Ⅲ)的配位数为___________。
(7)由热重曲线可知,当升温至170℃时失去2分子水,研究发现这部分水属于配合物外界,简述该配合
物中外界水较内界水易失去的原因可能是___________。
【答案】(1) ①. 水浴加热 ②. 促进铁离子水解
第15页/共22页
学科网(北京)股份有限公司(2)
(3)②④⑤⑥ (4)最后半滴标准液加入后,溶液紫色消失,且半分钟内不变色
(5)
(6)6 (7)内界水和铁通过配位键结合,而外界结晶水通过分子间作用力结合,配位键键能较大,故
内该配合物中外界水较内界水易失去
【解析】
【分析】配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、
摇匀、装瓶贴签;
滴定实验的步骤是:滴定前的准备:滴定管:查漏→洗涤→润洗→装液→调液面→记录,锥形瓶:注液体
→记体积→加指示剂;滴定:眼睛注视锥形瓶溶液颜色变化;终点判断:记录数据;数据处理:通过数据
进行计算;
【小问1详解】
硝酸铁固体在80℃加热条件下溶于去离子水得到溶液,则可以选用水浴加热;水解为吸热过程,加热的目
的是促进铁离子水解;
【小问2详解】
硝酸铁固体在溶于水时部分水解、缩合成一种重要的中间体 ,则反应为:
;
【小问3详解】
配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装
瓶贴签;滴定按照检漏、洗涤、润洗、装液、滴定等顺序操作;故该铁含量测定实验需要的仪器有:
250mL容量瓶、酸式滴定管等,无需使用的仪器有量筒、蒸发皿、分液漏斗、冷凝管;故选②④⑤⑥;
【小问4详解】
由已知反应可知,当滴定结束时,容易紫色硝酸,故滴定终点的现象是:最后半滴标准液加入后,溶液紫
色消失,且半分钟内不变色;
【小问5详解】
由已知反应可知, ,则产品中铁元素的含量是
第16页/共22页
学科网(北京)股份有限公司【小问6详解】
由结构可知,该阳离子中,Fe(Ⅲ)的配位数为6;
【小问7详解】
内界水和铁通过配位键结合,而外界结晶水通过分子间作用力结合,配位键键能较大,故内该配合物中外
界水较内界水易失去。
18. 乙 腈 又 名 甲 基 氰 , 是 重 要 的 化 工 产 品 。 乙 醇 氨 化 还 原 制 乙 腈 的 总 反 应 为
。
已知:Ⅰ. ;
Ⅱ. 。
(1)① ___________。
②在___________(填“较低”或“较高”)温度下,有利于总反应正向自发进行。
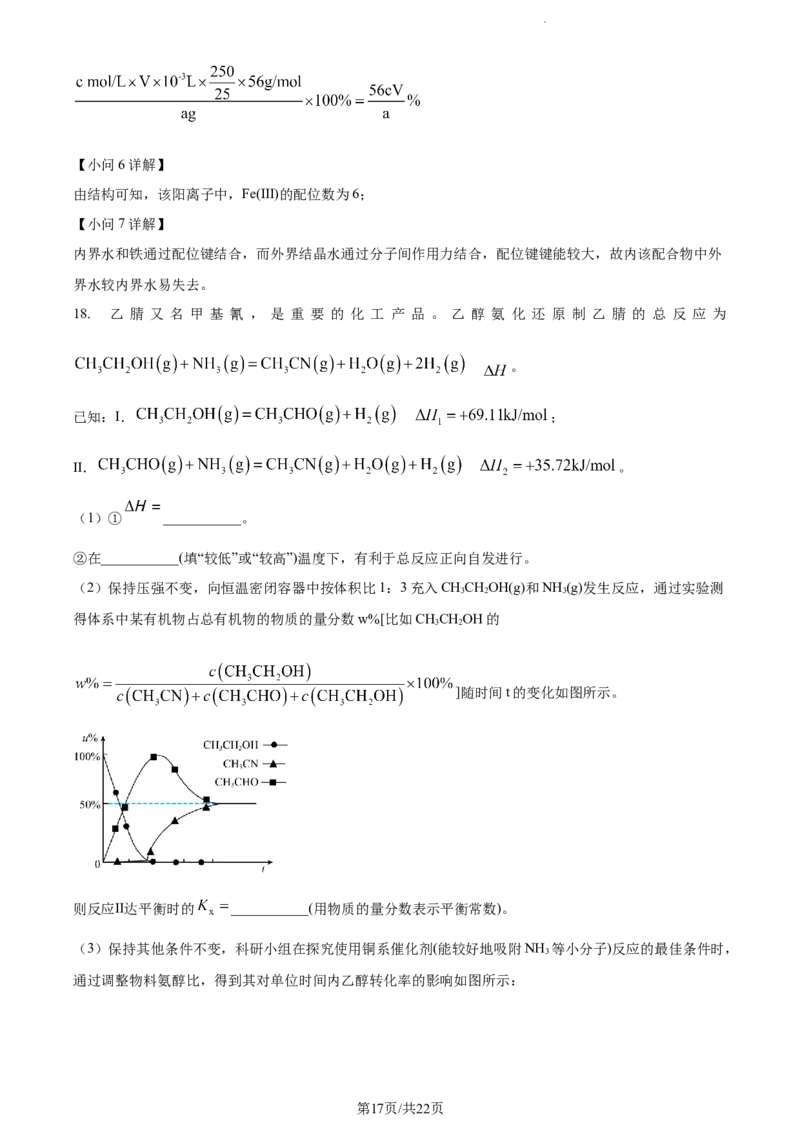
(2)保持压强不变,向恒温密闭容器中按体积比1:3充入CHCHOH(g)和NH (g)发生反应,通过实验测
3 2 3
得体系中某有机物占总有机物的物质的量分数w%[比如CHCHOH的
3 2
]随时间t的变化如图所示。
则反应Ⅱ达平衡时的 ___________(用物质的量分数表示平衡常数)。
(3)保持其他条件不变,科研小组在探究使用铜系催化剂(能较好地吸附NH 等小分子)反应的最佳条件时,
3
通过调整物料氨醇比,得到其对单位时间内乙醇转化率的影响如图所示:
第17页/共22页
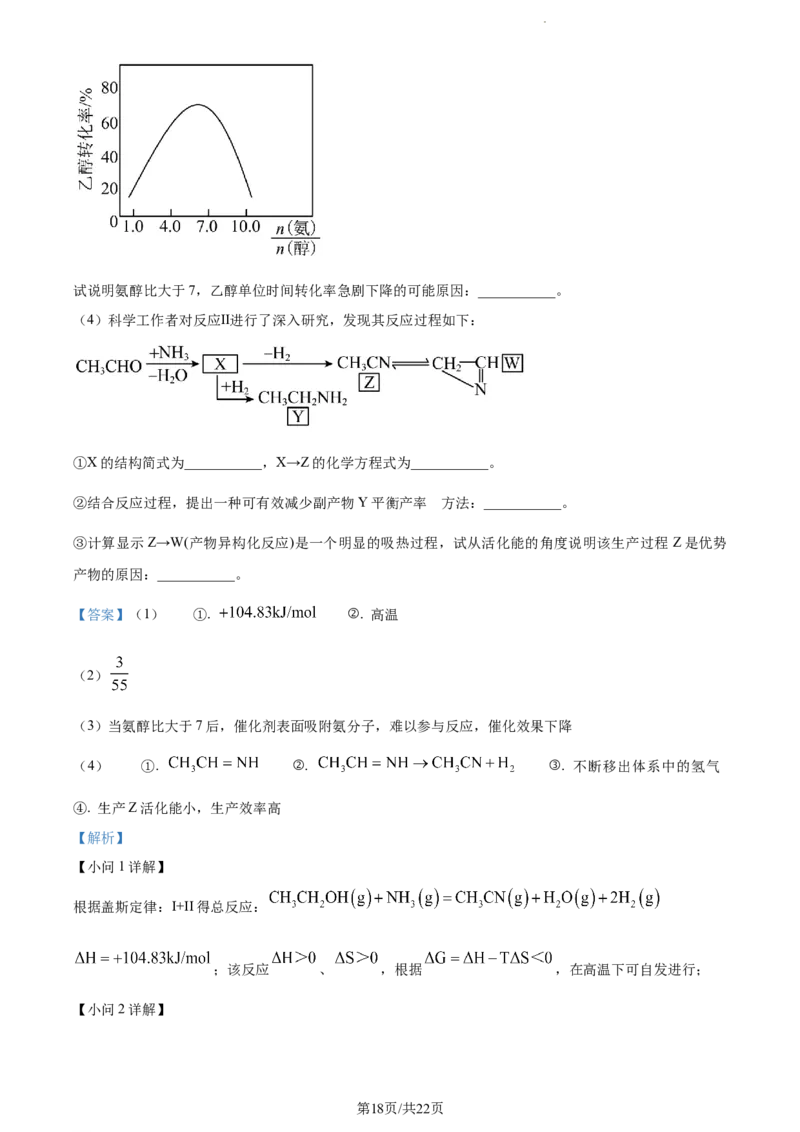
学科网(北京)股份有限公司试说明氨醇比大于7,乙醇单位时间转化率急剧下降的可能原因:___________。
(4)科学工作者对反应Ⅱ进行了深入研究,发现其反应过程如下:
①X的结构简式为___________,X→Z的化学方程式为___________。
②结合反应过程,提出一种可有效减少副产物Y平衡产率 方的法:___________。
③计算显示Z→W(产物异构化反应)是一个明显的吸热过程,试从活化能的角度说明该生产过程 Z是优势
产物的原因:___________。
【答案】(1) ①. ②. 高温
(2)
(3)当氨醇比大于7后,催化剂表面吸附氨分子,难以参与反应,催化效果下降
(4) ①. ②. ③. 不断移出体系中的氢气
④. 生产Z活化能小,生产效率高
【解析】
【小问1详解】
根据盖斯定律:I+II得总反应:
;该反应 、 ,根据 ,在高温下可自发进行;
【小问2详解】
第18页/共22页
学科网(北京)股份有限公司设初始CHCHOH(g)充入1mol,NH (g)充入3mol;根据图示可知,平衡时乙醛和乙腈物质的量分数都是
3 2 3
50%,说明二者物质的量相等,无乙醇存在,根据碳原守恒,体系中有0.5mol的乙醛和0.5mol乙腈;反应
I生成1mol氢气,反应II消耗0.5mol氨气,生成0.5mol水蒸气和0.5mol氢气,即平衡体系中有0.5mol乙
醛,0.5mol乙腈,1.5mol氢气,2.5mol氨气和0.5mol水蒸气。气体总物质的量5.5mol,乙醛、乙腈和水蒸
气物质的量分数: ,氢气物质的量是乙醛3倍为 ,氨气物质的量是乙醛5倍为 ,代入
表达式: ;
【小问3详解】
铜系催化剂能较好地吸附NH 等小分子,当氨醇比大于7后,催化剂表面吸附氨分子,难以参与反应,催
3
化效果下降,导致乙醇单位时间内转化率急剧降低;
【小问4详解】
①根据Y和Z的结构简式及反应条件,可推出X的结构简式: ;X→Z的化学方程式:
;
②结合反应过程可知,不断移出体系中的氢气,可有效减少副产物Y平衡产率;
③Z→W(产物异构化反应)是一个吸热过程,说明Z物质能量较低,生产Z活化能小,生产效率高;
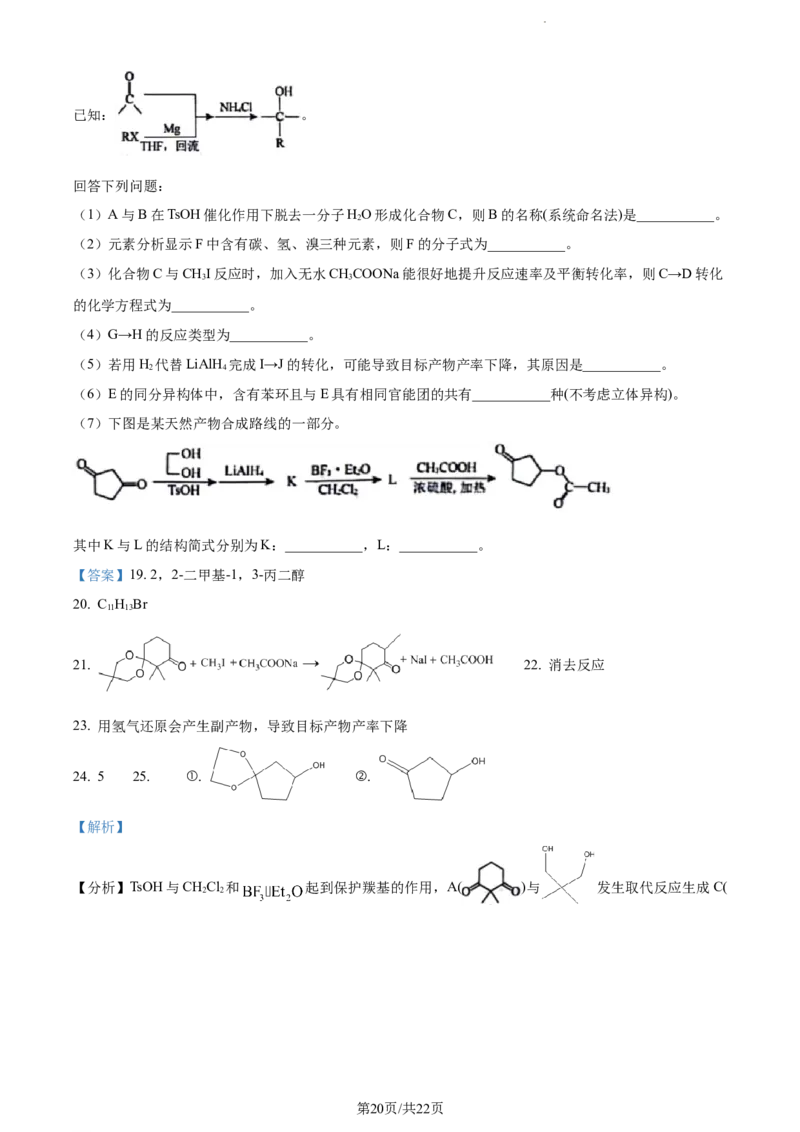
19. 松香烷二萜类化合物具有良好的生物活性,广泛分布于自然界中。由米团花分离出的松香烷二萜J的合
成路线如下:
第19页/共22页
学科网(北京)股份有限公司已知: 。
回答下列问题:
(1)A与B在TsOH催化作用下脱去一分子HO形成化合物C,则B的名称(系统命名法)是___________。
2
(2)元素分析显示F中含有碳、氢、溴三种元素,则F的分子式为___________。
(3)化合物C与CHI反应时,加入无水CHCOONa能很好地提升反应速率及平衡转化率,则C→D转化
3 3
的化学方程式为___________。
(4)G→H的反应类型为___________。
(5)若用H 代替LiAlH 完成I→J的转化,可能导致目标产物产率下降,其原因是___________。
2 4
(6)E的同分异构体中,含有苯环且与E具有相同官能团的共有___________种(不考虑立体异构)。
(7)下图是某天然产物合成路线的一部分。
其中K与L的结构简式分别为K:___________,L:___________。
【答案】19. 2,2-二甲基-1,3-丙二醇
20. C H Br
11 13
21. 22. 消去反应
23. 用氢气还原会产生副产物,导致目标产物产率下降
24. 5 25. ①. ②.
【解析】
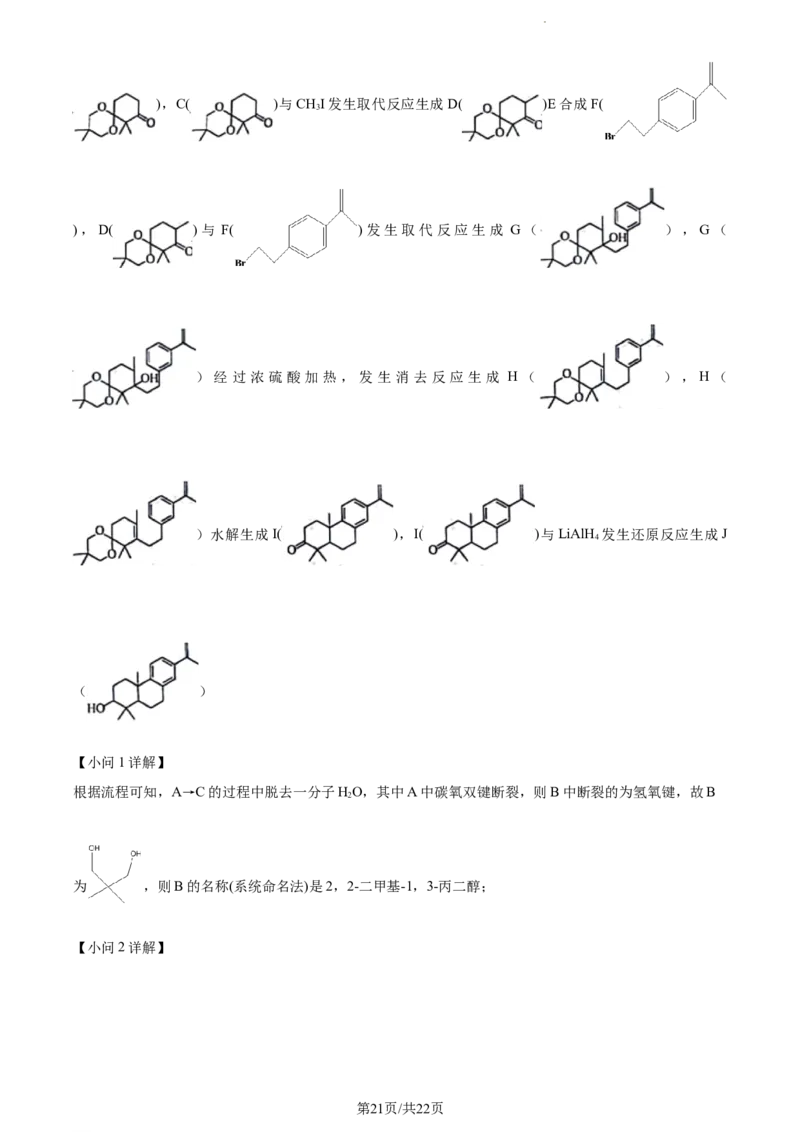
【分析】TsOH与CHCl 和 起到保护羰基的作用,A( )与 发生取代反应生成C(
2 2
第20页/共22页
学科网(北京)股份有限公司),C( )与CHI发生取代反应生成D( )E合成F(
3
),D( )与 F( )发生取代反应生成 G( ),G(
)经过浓硫酸 加热 ,发生消去反 应生成 H( ), H(
)水解生成I( ),I( )与LiAlH 发生还原反应生成J
4
( )
【小问1详解】
根据流程可知,A→C的过程中脱去一分子HO,其中A中碳氧双键断裂,则B中断裂的为氢氧键,故B
2
为 ,则B的名称(系统命名法)是2,2-二甲基-1,3-丙二醇;
【小问2详解】
第21页/共22页
学科网(北京)股份有限公司F与D反应生成G,由已知可以推断出F为 ,则F的分子式为C H Br;
11 13
【小问3详解】
C与CHI发生取代反应生成HI,HI再与CHCOONa反应生成NaI和CHCOOH,则C→D转化的化学方
3 3 3
程式为 ;
【小问4详解】
G→H过程中羟基变为碳碳双键,故反应类型为消去反应;
【小问5详解】
氢气除了还原羰基之外还可以还原苯环,产生副产物,导致目标产物产率下降;
【小问6详解】
E 同分异构体除E之外还有以下五种 、 、苯环上的二取代物 (邻、
的
间、对三种),故含有苯环且与E具有相同官能团的共有5种。
【小问7详解】
与 反应生成 , 与LiAlH 反应生成
4
, 与CHCl 和 反应生成 ,故K的结构
2 2
简式为 ,L的结构简式为 。
第22页/共22页
学科网(北京)股份有限公司