文档内容
【解析】A.发生吸热反应:C(s)+HO(g)=H (g)+CO(g),多加煤不会使煤炭燃烧充分,故 A错
高一下学期第八单元达标检测卷 2 2
误;B.把煤炭做成大煤球,燃烧更不充分,故B错误;C.把煤粉碎,煤与空气的接触面积最大,
化 学(A) 燃烧最充分,故C正确;D.把煤中掺一些黄泥做成蜂窝煤,增大表面积,燃烧较充分,但是不能
提高热能利用率,故D错误;故选C。
注意事项: 3.食品卫生与人们的身体健康密切相关,下列做法符合《食品卫生法》的是
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码 A.使用工业用盐腌制咸菜
粘贴在答题卡上的指定位置。 B.在牛奶中添加尿素
2.选择题的作答:每小题选出答案后,用 2B铅笔把答题卡上对应题目的答案标号涂黑,
C.使用二氧化硫熏制银耳
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
D.使用纯碱发酵面食
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿
【答案】D
纸和答题卡上的非答题区域均无效。
【解析】工业用盐中含NaNO ,NaNO 有毒;二氧化硫有毒;尿素不能用作食品添加剂。
2 2
4.考试结束后,请将本试题卷和答题卡一并上交。
4.石油被誉为“工业的血液”,其分馏产品中沸点最高的是
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 K 39 Cu 64 A.重油 B.汽油 C.柴油 D.石油气
【答案】A
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。)
【解析】汽油(碳原子数7−11)、柴油(碳原子数16−18)、重油(碳原子数>20)、液化石油气(碳原
1.《五金·铁》中记载:“若造熟铁,则生铁流出时,相连数尺内,低下数寸,筑一方塘,短墙抵
子数1−4)的晶体类型都属于分子晶体,分子中碳原子数越多,分子间作用力越大,沸点越高,根
之。其铁流入塘内,数人执柳木排立墙上……众人柳棍疾搅,即时炒成熟铁。”以下说法不正
据分子中碳原子多少可比较沸点高低。沸点由低到高为液化石油气,汽油,煤油,柴油,重油。石
确的是
油分馏,先出石油气,然后是汽油,再就是煤油。剩下的是重油。故选B。
A.金属冶炼方法由金属活动性决定
5.下列关于食品添加剂的叙述不正确的是
B.熟铁比生铁质地更硬,延展性稍差
A.胭脂红可以作为着色剂少量使用
C.炒铁是为了降低铁水中的碳含量
B.亚硝酸钠可以用作防腐剂少量使用
D.该法与近代往生铁水中吹空气炼钢异曲同工
C.味精可用作增味剂少量使用
【答案】B
D.酱油中可加入少量氯化铁作营养强化剂补铁
【解析】活泼性不同的金属,其冶炼方法不同,即金属冶炼方法由金属活动性决定,故 A正确;
【答案】D
熟铁比生铁质地更硬,且延展性好,故B错误;炒铁过程中降低了铁水中的碳含量,从而将生铁
【解析】A.胭脂红是我国允许在食品加工中使用的一种合成色素,食品添加剂胭脂红限量使
转化成熟铁,故C正确;该冶炼方法和近代往生铁水中吹空气炼钢,都是利用空气中氧气氧化碳
用是无毒的,A正确;B.亚硝酸钠可用作防腐剂,但应该适量,但如摄入过量的亚硝酸钠,会产
元素,其原理基本相同,故D正确。
生致癌物质亚硝酸胺,B正确;C.味精是谷氨酸的一种钠盐,是一种增鲜味的调料,少量合理使
2.下列措施,能使煤炭燃烧更充分,提高热能利用率的是
用味精,炒菜、做馅、拌凉菜、做汤等都可使用,是一种安全调味剂,C正确;D.铁强化酱油是
A.多加煤以使炉火更旺
以强化营养为目的,按照标准在酱油中加入一定量的乙二胺四乙酸铁钠制成的营养强化调味品,但
B.把煤炭做成大煤球
C.把煤粉碎,在煤粉燃烧器中燃烧 不能加氯化铁,D错误;故选D。
D.把煤中掺和一些黄泥做成蜂窝煤 6.热还原法冶炼金属的反应一定是
【答案】C A.置换反应 B.分解反应 C.复分解反应 D.氧化还原反应
【答案】D
封密不订装只卷此
号位座
号场考
号证考准
名姓
级班【解析】热还原法冶炼金属常用的还原剂是C、H 、CO、Al等,若是单质作还原剂,发生的
2
是置换反应,同时也属于氧化还原反应;若是CO作还原剂,则发生氧化还原反应。
7.工业上制备下列物质的生产流程不合理的是
A.由铝土矿冶炼铝:铝土矿
B.由重晶石制可溶性钡盐:重晶
C.由石英砂制高纯硅:石英砂
D.由黄铁矿制硫酸:
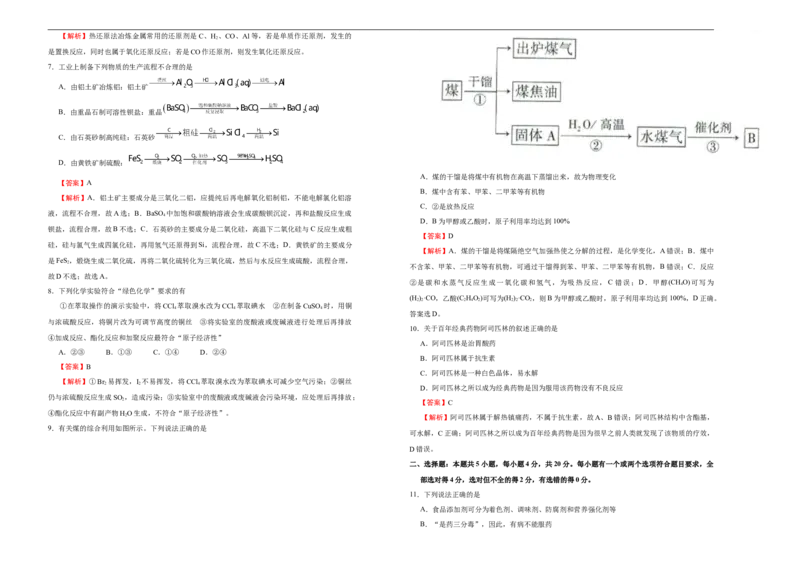
A.煤的干馏是将煤中有机物在高温下蒸馏出来,故为物理变化
【答案】A
B.煤中含有苯、甲苯、二甲苯等有机物
【解析】A.铝土矿主要成分是三氧化二铝,应提纯后再电解氧化铝制铝,不能电解氯化铝溶
C.②是放热反应
液,流程不合理,故A选;B.BaSO 中加饱和碳酸钠溶液会生成碳酸钡沉淀,再和盐酸反应生成
4
D.B为甲醇或乙酸时,原子利用率均达到100%
钡盐,流程合理,故B不选;C.石英砂的主要成分是二氧化硅,高温下二氧化硅与C反应生成粗
【答案】D
硅,硅与氯气生成四氯化硅,再用氢气还原得到Si,流程合理,故C不选;D.黄铁矿的主要成分
【解析】A.煤的干馏是将煤隔绝空气加强热使之分解的过程,是化学变化,A错误;B.煤中
是FeS,煅烧生成二氧化硫,再将二氧化硫转化为三氧化硫,然后与水反应生成硫酸,流程合理,
2
不含苯、甲苯、二甲苯等有机物,可通过干馏得到苯、甲苯、二甲苯等有机物,B错误;C.反应
故D不选;故选A。
②是碳和水蒸气反应生成一氧化碳和氢气,为吸热反应,C 错误;D.甲醇(CHO)可写为
4
8.下列化学实验符合“绿色化学”要求的有
(H )·CO,乙酸(C HO)可写为(H )·CO ,则B为甲醇或乙酸时,原子利用率均达到100%,D正确。
2 2 2 4 2 2 2 2
①在萃取操作的演示实验中,将CCl 萃取溴水改为CCl 萃取碘水 ②在制备CuSO 时,用铜
4 4 4
答案选D。
与浓硫酸反应,将铜片改为可调节高度的铜丝 ③将实验室的废酸液或废碱液进行处理后再排放
10.关于百年经典药物阿司匹林的叙述正确的是
④加成反应、酯化反应和加聚反应最符合“原子经济性”
A.阿司匹林是治胃酸药
A.②③ B.①③ C.①④ D.②④
B.阿司匹林属于抗生素
【答案】B
C.阿司匹林是一种白色晶体,易水解
【解析】①Br 易挥发,I 不易挥发,将CCl 萃取溴水改为萃取碘水可减少空气污染;②铜丝
2 2 4
D.阿司匹林之所以成为经典药物是因为服用该药物没有不良反应
仍与浓硫酸反应生成SO ,造成污染;③实验室中的废酸液或废碱液会污染环境,应处理后再排放;
2 【答案】C
④酯化反应中有副产物HO生成,不符合“原子经济性”。
2 【解析】阿司匹林属于解热镇痛药,不属于抗生素,故A、B错误;阿司匹林结构中含酯基,
9.有关煤的综合利用如图所示。下列说法正确的是
可水解,C正确;阿司匹林之所以成为百年经典药物是因为很早之前人类就发现了该物质的疗效,
D错误。
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全
部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列说法正确的是
A.食品添加剂可分为着色剂、调味剂、防腐剂和营养强化剂等
B.“是药三分毒”,因此,有病不能服药C.加碘盐即为加入少量单质碘的食盐 【解析】海水蒸发溶剂得到粗盐和母液,粗盐通过精制得到精盐,电解饱和食盐水得到氯气、
D.人体的功能物质只有糖类和油脂 氢气和氢氧化钠,工业上制得饱和食盐水依次通入氨气、二氧化碳反应生成碳酸氢钠和氯化铵,碳
【答案】A 酸氢钠受热分解生成碳酸钠,母液加氢氧化钠反应生成氢氧化镁沉淀,氢氧化镁和酸反应生成氨化
【解析】A.食品添加剂有的能使食品有诱人的颜色,即为着色剂;有的能使食品呈现特殊的
镁,制得氢化镁,母液通入氨气氧化溴离子为溴单质,被二氧化硫吸收后发生氧化还原反应生成溴
味道,即为调味剂;有的能起到防止食品腐烂、延长食品保质期的作用,即为防腐剂;还有的能强
化氢溶液,富集溴元素,通入氨气氧化溴化氢为溴单质得到溴。A.①的操作是先通入足量的
化某种营养,即为营养强化剂,故A正确;B.合理用药有利于健康,药品能使病人恢复健康,故
NH ,因为先通入氨气是因为氨气在水中的溶解度非常大,在水中形成氨的水溶液,溶液的碱性比
3
B错误;C.加碘盐中加入的是碘酸钾,而不是碘单质,故 C错误;D.糖类、油脂和蛋白质均能
较强易于吸收更多的二氧化碳,从而产生更多的纯碱,故A正确;B.因氯化镁水解,且生成的盐
为人体供能,而不是只有糖类和油脂,故D错误;故选A。
酸易挥发,所以应在HCl气流中加热,故B正确;C.二者与澄清石灰水都反应产生CaCO 沉淀,
3
12.卫生部向社会及媒体发布《保持健康体重知识要点》,向肥胖“宣战”。对肥胖者而言,要想
使溶液变浑浊,因此不能用澄清石灰水鉴别二者,故C错误;D.第③步反应是二氧化硫具有还原
达到健康体重,下列做法科学的是
性,能还原溴单质生成溴离子,二氧化硫被氧化为硫酸,Br +SO+2H O=4H++SO+2Br−,故D错误;
2 2 2
①每天饭后步行三十分钟;②采用不吃早餐等节食方法减轻体重;③利用药物减轻体重是目前
故选AB。
最科学有效的方法;④食物多样,少食高热量、油炸食物,控制膳食总热量;⑤不喝或少喝奶茶、
14.2020年11月20日,宁德市被授予全国文明城市称号。为营造可持续发展的生态环境,宁德市
可乐等饮料,养成每天喝水的习惯
全面推广垃圾分类和生活垃圾无害化处理。下列说法不合理的是
A.①③⑤ B.②④⑤ C.②③⑤ D.①④⑤
A.废弃的玻璃、金属、塑料等均不能再回收利用
【答案】D
B.垃圾露天焚烧,会产生有害气体(如HCl、NO 、SO 等),导致大气污染
x 2
【解析】①饭后步行30分钟,有助于食物的消化和脂肪的消耗,符合题意;②不吃早餐,容易
C.废旧电池中含汞、镉、铅等重金属,不能就地填埋
引发低血糖,且对胃和胆囊都有伤害,不符合题意;③药物减肥对身体有副作用,且停药后体重很
D.集中回收厨余垃圾,可以用于生产沼气
容易反弹,不符合题意;④食物多样有助于营养的均衡,少吃高热量、油炸食物,减少了油脂的摄
【答案】A
入,有助于减肥,符合题意;⑤不喝或少喝奶茶、可乐等饮料,能减少糖类的摄入,可防止体内糖 【解析】A.废弃的玻璃、金属、塑料是可回收利用的资源,故A不合理;B.垃圾露天焚烧,
类过剩转化为脂肪,符合题意;综上所述,①④⑤符合题意,故答案选D。 会产生有害气体(如HCl、NO 、SO 等),导致大气污染,故B合理;C.废旧电池中含汞、镉、铅
x 2
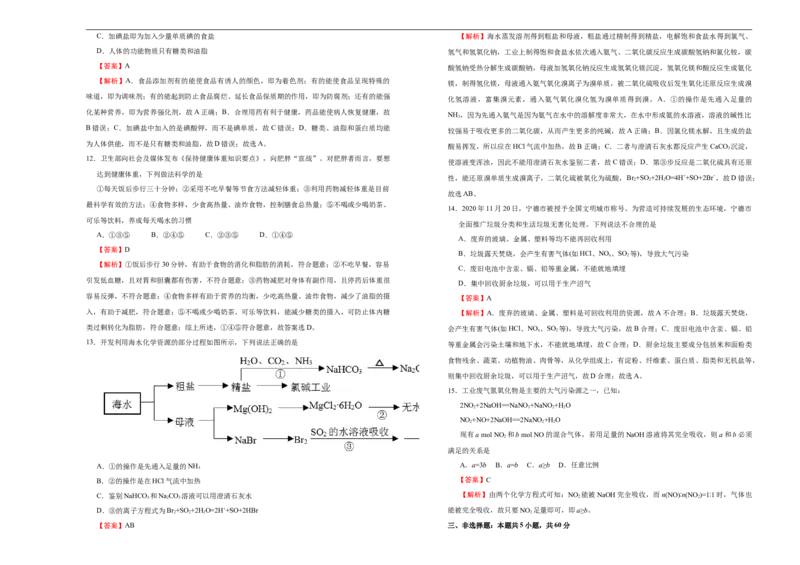
13.开发利用海水化学资源的部分过程如图所示,下列说法正确的是
等重金属会污染土壤和地下水,不能就地填埋,故C合理;D.厨余垃圾主要成分包括米和面粉类
食物残余、蔬菜、动植物油、肉骨等,从化学组成上,有淀粉、纤维素、蛋白质、脂类和无机盐等,
则集中回收厨余垃圾,可以用于生产沼气,故D合理;故选A。
15.工业废气氮氧化物是主要的大气污染源之一,已知:
2NO +2NaOH==NaNO +NaNO +H O
2 3 2 2
NO +NO+2NaOH==2NaNO +H O
2 2 2
现有a mol NO 和b mol NO的混合气体,若用足量的NaOH溶液将其完全吸收,则a和b必须
2
满足的关系是
A.①的操作是先通入足量的NH A.a=3b B.a=b C.a≥b D.任意比例
3
B.②的操作是在HCl气流中加热 【答案】C
C.鉴别NaHCO 和NaCO 溶液可以用澄清石灰水 【解析】由两个化学方程式可知:NO 能被NaOH完全吸收,而n(NO)∶n(NO )=1∶1时,气体也
3 2 3 2 2
D.③的离子方程式为Br +SO+2H O=2H++SO+2HBr 能被完全吸收,故只要NO 足量即可,即a≥b。
2 2 2 2
【答案】AB 三、非选择题:本题共5小题,共60分16.铝热反应常用于冶炼高熔点的金属,可简单认为是铝与某些金属氧化物在高温条件下发生的反
应。某学习小组对铝热反应(以Al和Fe O 反应为例)进行研究。
2 3
查阅资料得到Al、Al O、Fe、Fe O 的熔、沸点数据如表所示:
2 3 2 3
物质 Al Al O Fe Fe O
2 3 2 3
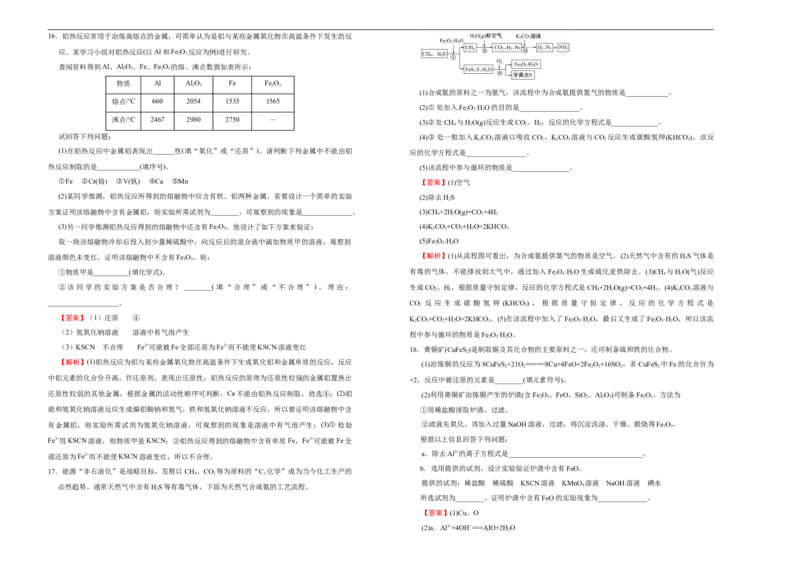
(1)合成氨的原料之一为氮气,该流程中为合成氨提供氮气的物质是____________。
熔点/℃ 660 2054 1535 1565
(2)① 处加入Fe O·H O的目的是_________________。
2 3 2
沸点/℃ 2467 2980 2750 —
(3)②处CH 与HO(g)反应生成CO、H,反应的化学方程式是_____________。
4 2 2 2
试回答下列问题: (4)③ 处一般加入KCO 溶液以吸收CO ,KCO 溶液与CO 反应生成碳酸氢钾(KHCO),该反
2 3 2 2 3 2 3
(1)在铝热反应中金属铝表现出______性(填“氧化”或“还原”)。请判断下列金属中不能由铝 应的化学方程式是_________________。
热反应制取的是____________(填序号)。 (5)该流程中参与循环的物质是________________。
①Fe ②Cr(铬) ③V(钒) ④Ca ⑤Mn 【答案】(1)空气
(2)某同学推测,铝热反应所得到的熔融物中应含有铁、铝两种金属。若要设计一个简单的实验 (2)除去HS
2
方案证明该熔融物中含有金属铝,则实验所需试剂为________,可观察到的现象是______________。 (3)CH +2H O(g)=CO+4H
4 2 2 2
(3)另一同学推测铝热反应得到的熔融物中还含有Fe O,他设计了如下方案来验证: (4)K CO+CO +H O=2KHCO
2 3 2 3 2 2 3
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到 (5)Fe O·H O
2 3 2
溶液颜色未变红,证明该熔融物中不含有Fe 2 O 3 。则: 【解析】(1)从流程图可看出,为合成氨提供氮气的物质是空气。(2)天然气中含有的H 2 S气体是
①物质甲是__________(填化学式)。 有毒的气体,不能排放到大气中,通过加入Fe O·H O生成硫化亚铁除去。(3)CH 与HO(气)反应
2 3 2 4 2
②该同学的实验方案是否合理?________(填“合理”或“不合理”)。理由: 生成CO、H,根据质量守恒定律,反应的化学方程式是CH+2H O(g)=CO+4H 。(4)K CO 溶液与
2 2 4 2 2 2 2 3
____________________。 CO 反 应 生 成 碳 酸 氢 钾 (KHCO) , 根 据 质 量 守 恒 定 律 , 反 应 的 化 学 方 程 式 是
2 3
【答案】(1)还原 ④ KCO+CO +H O=2KHCO 。(5)在该流程中加入了Fe O·H O,最后又生成了Fe O·H O,所以该流
2 3 2 2 3 2 3 2 2 3 2
(2)氢氧化钠溶液 溶液中有气泡产生
程中参与循环的物质是Fe O·H O。
2 3 2
(3)KSCN 不合理 Fe3+可能被Fe全部还原为Fe2+而不能使KSCN溶液变红
18.黄铜矿(CuFeS)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
2
【解析】(1)铝热反应为铝与某些金属氧化物在高温条件下生成氧化铝和金属单质的反应,反应
(1)冶炼铜的反应为8CuFeS+21O =====8Cu+4FeO+2Fe O+16SO ,若CuFeS 中Fe的化合价为
2 2 2 3 2 2
中铝元素的化合价升高,作还原剂,表现出还原性;铝热反应的原理为还原性较强的金属铝置换出
+2,反应中被还原的元素是________(填元素符号)。
还原性较弱的其他金属,根据金属的活动性顺序可判断,Ca不能由铝热反应制取,故选④;(2)铝 (2)利用黄铜矿冶炼铜产生的炉渣(含Fe O、FeO、SiO、Al O)可制备Fe O。方法为
2 3 2 2 3 2 3
能和氢氧化钠溶液反应生成偏铝酸钠和氢气,铁和氢氧化钠溶液不反应,所以要证明该熔融物中含 ①用稀盐酸浸取炉渣,过滤。
有金属铝,则实验所需试剂为氢氧化钠溶液,可观察到的现象是溶液中有气泡产生;(3)① 检验 ②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe
2
O
3
。
Fe3+用KSCN溶液,则物质甲是KSCN;②铝热反应得到的熔融物中含有单质Fe,Fe3+可能被Fe全 根据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________________________________。
部还原为Fe2+而不能使KSCN溶液变红,所以不合理。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
17.能源“非石油化”是战略目标,发展以CH 、CO 等为原料的“C 化学”成为当今化工生产的
4 2 1
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO 溶液 NaOH溶液 碘水
必然趋势。通常天然气中含有HS等有毒气体,下面为天然气合成氨的工艺流程。 4
2
所选试剂为________。证明炉渣中含有FeO的实验现象为______________。
【答案】(1)Cu、O
(2)a.Al3++4OH−===AlO+2H O
2b.稀硫酸、KMnO 溶液 稀硫酸浸取炉渣所得溶液使KMnO 溶液褪色 【解析】(1)发动机工作时汽缸中的压强和温度都很高,空气中 N 和 O 发生如下反应:
4 4 2 2
【解析】(1)分析方程式中各元素化合价可知:Cu→Cu,O→O,氧元素、铜元素在反应中被还
原。(2)Al3+与过量的氢氧化钠溶液反应生成偏铝酸钠溶液,而Fe3+与氢氧化钠溶液反应生成氢氧化
、 ,生成污染大气的NO 、NO;(2)汽车尾气主要是氮的氧
2
铁沉淀,过滤,将Al3+除去。反应的离子方程式为Al3++4OH−===AlO+2H O。若要证明炉渣中含有
2
FeO需要首先将其溶解,生成含有可溶性亚铁盐的溶液,结合试剂分析可知,将该溶液加入高锰酸 化物,形成光化学烟雾,工业废气中含有二氧化硫,造成酸雨,工业废水中含有很多有害的元素,
钾溶液中,亚铁离子具有还原性,可以使高锰酸钾溶液褪色。Cl−可与MnO发生氧化还原反应,对 可以形成公害病,故选B;(3)由于题述反应仅能“缓慢”发生,故可“催化”加速;由于正反应为
实验结果有干扰,则用稀硫酸溶解炉渣。因此,选用的试剂是稀硫酸和高锰酸钾溶液。 放热过程,故温度不宜太高;由于正反应为气体总体积减小的反应,故不宜减压;装置中加入能与
19.汽车的发明与使用,是人类智慧的杰出体现,它为人们的生活和生产带来了极大的方便,同时
产物CO 反应的物质有利于平衡右移,故选C;(4)CO 和H 均不属于有毒气体,故选A;(5)“绿色
2 2 2
由此引发的环境污染问题也越来越引起人们的关注。
汽车”是指使用液化石油气作能源的汽车﹒绿色汽车可避免有毒的铅、苯的同系物以及稠环芳经的
(1)汽车排放的尾气中因含有氮的氧化物而污染大气,产生氮的氧化物的主要原因是______(填字
排放,燃烧等质量的液化石油气(主要成分是含C ~C 的经)与汽油相比较前者产生的含碳化合物
3 4
母,下同)。
少,故选D;(6)天然气(主要成分CH)、液化石油气(C ~C 的经)其成分中只含C、H元素,所以
4 3 4
A.燃烧含氮燃料 B.燃烧含铅汽油 C.汽油燃烧不充分 D.汽缸中的N 被氧
2 均为碳氢化合物,完全燃烧的产物为CO 和HO,不会造成环境污染,但生成的CO 却是造成温室
2 2 2
化
效应的元凶,故选B。
(2)下列有关城市各项污染源与其造成的恶果对应关系正确的是______。
20.食品和药品关系着人的生存和健康。
A.汽车尾气——光化学烟雾;工业废气——酸雨;工业废水——“公害病”
(1)市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是
B.汽车尾气——酸雨;工业废气——“公害病”;工业废水——光化学烟雾
_______(填标号,下同)。
C.汽车尾气——“公害病”;工业废气——酸雨;工业废水——光化学烟雾
A.加锌盐 B.加碘盐 C.加钙盐
D.汽车尾气——光化学烟雾;工业废气——“公害病”;工业废水——酸雨
(2)纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕
(3)新型环保出租车采用LPG+汽油的双燃料系统,其尾气中的有毒成分较普通车型下降80%左
动、吸附排出有害物质。从化学成分看,纤维素是一种___________。
右,缓解了汽车尾气排放给城市环境造成的污染问题。下列不属于上述有毒成分的是______。
A.多糖 B.蛋白质 C.脂肪
A.CO 和H B.NO 和NO C.CO和SO D.C粒和含铅化合物
2 2 2 2
(3)某同学感冒发烧,他可服用下列哪种药品进行治疗___________。
(4)所谓“绿色汽车”是指使用液化石油气等无污染或污染较小的能源作燃料的汽车。绿色汽车
A.青蒿素类药物 B.阿司匹林 C.抗酸药
可避免有毒的铅、苯和苯的同系物以及稠环芳烃的排放。燃烧等质量的液化石油气(主要成分是含
(4)某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉,写出该抗酸药发挥功效时的离
3〜4个碳原子的烃)与汽油相比较______。
子方程式:___________。
A.前者生成的水少 B.前者消耗氧气量少
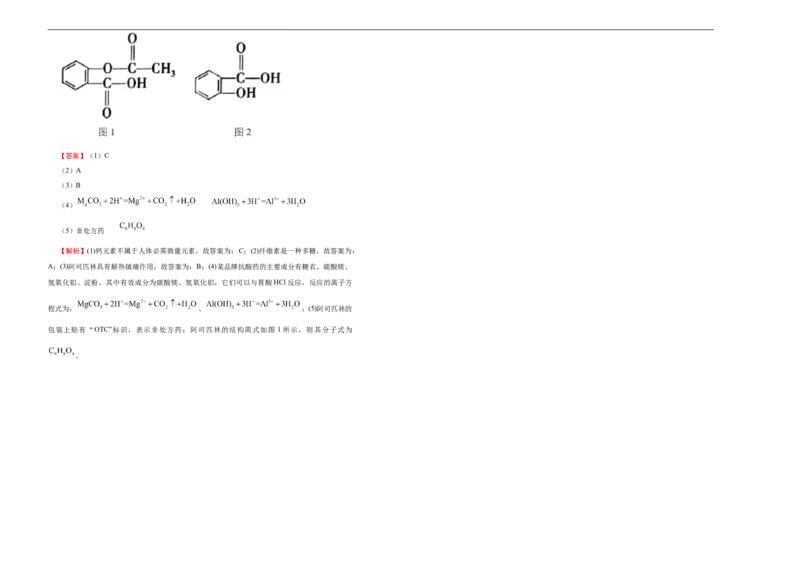
(5)阿司匹林的包装上贴有“OTC”标识,表示___________,阿司匹林的结构简式如图所示,则
C.前者燃烧产生的污染物多 D.前者产生的含碳化合物种类少
其分子式为___________。
(5)为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类:一
类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是______。
A.碳水化合物 B.碳氢化合物 C.氢气 D.醇类
【答案】(1)D (2)A (3)A (4)D (5)B【答案】(1)C
(2)A
(3)B
(4)
(5)非处方药
【解析】(1)钙元素不属于人体必需微量元素,故答案为:C;(2)纤维素是一种多糖,故答案为:
A;(3)阿司匹林具有解热镇痛作用,故答案为:B;(4)某品牌抗酸药的主要成分有糖衣、碳酸镁、
氢氧化铝、淀粉,其中有效成分为碳酸镁、氢氧化铝,它们可以与胃酸HCl反应,反应的离子方
程式为: 、 ;(5)阿司匹林的
包装上贴有“OTC”标识,表示非处方药;阿司匹林的结构简式如图 1 所示,则其分子式为
。