文档内容
第五章 化工生产中的重要非金属元素
章末检测
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.历史表明没有新材料的出现,就没有科技和生产发展的突破。信息高速公路的建立在于寻找新的
信息材料。下列材料可作信息材料的是( )
A.铜线 B.化纤 C.橡胶 D.光导纤维
2.下列有关氮元素的单质及其化合物的说法错误的是( )
①氮气与氧气在放电的条件下可直接生成NO
2
②铵盐都不稳定,受热分解都生成氨气
③向Fe(NO ) 溶液中滴加稀盐酸,无明显的变化
3 2
④实验室加热氯化铵固体,用碱石灰除氯化氢的方法制备氨气
A.①③④ B.①③ C.①④ D.①②③④
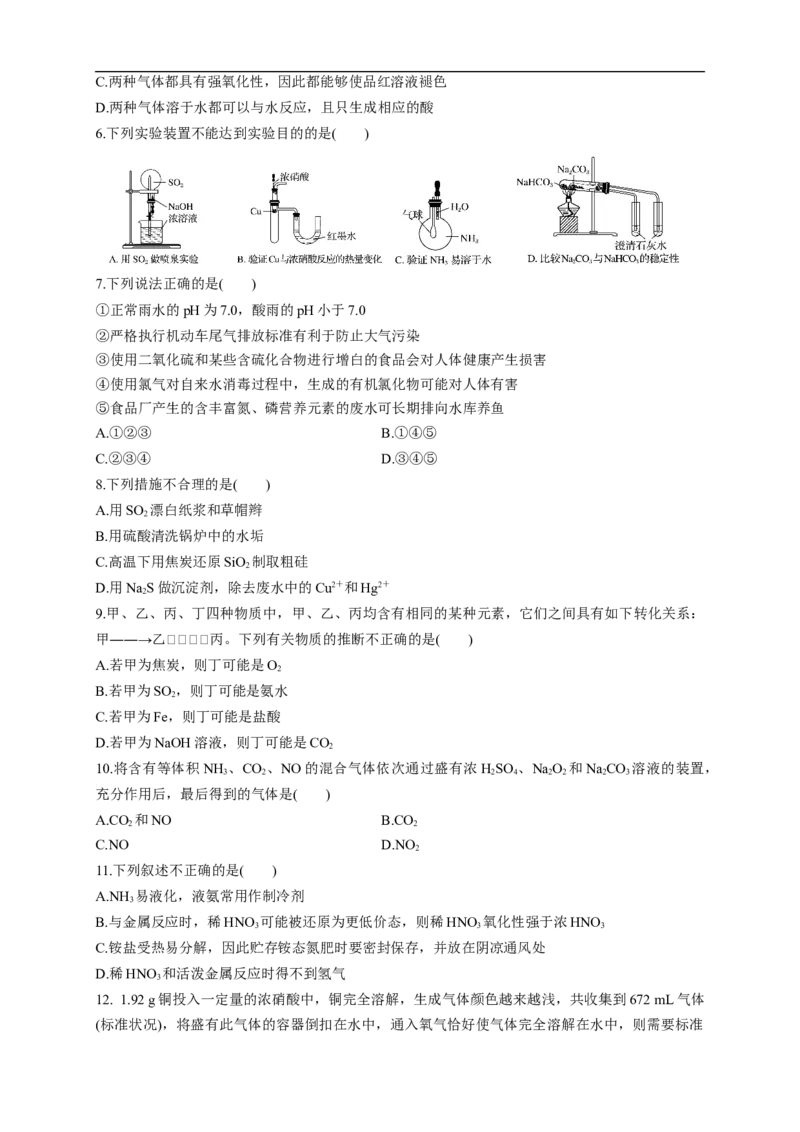
3.如图,利用培养皿探究SO 的性质。实验时向NaSO 固体上滴几滴浓硫酸,立即用另一表面皿扣
2 2 3
在上面。
下表中对实验现象的描述或所做的解释不正确的是( )
选项 实验现象 解释
A BaCl 溶液变浑浊 SO 与BaCl 溶液反应产生了BaSO 沉淀
2 2 2 3
B NaS溶液变浑浊 SO 与NaS溶液反应产生了S单质
2 2 2
C 酸性KMnO 溶液褪色 SO 具有还原性
4 2
D 品红溶液褪色 SO 具有漂白性
2
4.有a、b、c、d、e五种气体,进行下列实验:
(1)a和b混合 气体变红棕色
(2)c和d混合 产生白烟
(3)c和e分别通入少量溴水中 溴水都变成无色透明的液体
(4)b和e分别通入氢硫酸中 都产生淡黄色浑浊
a、b、c、d、e依次可能是( )
A.O、NO、HCl、NH 、CO
2 3 2
B.O 、NO、NH 、HCl、SO
2 3 2
C.NO、O、NH 、HCl、SO
2 3 2
D.HCl、CO、NH 、HS、CH
2 3 2 4
5.关于二氧化硫和二氧化氮叙述正确的是( )
A.两种气体都是无色有毒的气体,且都可用水吸收以消除对空气的污染
B.二氧化硫与过量的二氧化氮混合后通入水中能得到两种常用的强酸C.两种气体都具有强氧化性,因此都能够使品红溶液褪色
D.两种气体溶于水都可以与水反应,且只生成相应的酸
6.下列实验装置不能达到实验目的的是( )
7.下列说法正确的是( )
①正常雨水的pH为7.0,酸雨的pH小于7.0
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品会对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养元素的废水可长期排向水库养鱼
A.①②③ B.①④⑤
C.②③④ D.③④⑤
8.下列措施不合理的是( )
A.用SO 漂白纸浆和草帽辫
2
B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO 制取粗硅
2
D.用NaS做沉淀剂,除去废水中的Cu2+和Hg2+
2
9.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
甲――→乙丙。下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O
2
B.若甲为SO ,则丁可能是氨水
2
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO
2
10.将含有等体积NH 、CO 、NO的混合气体依次通过盛有浓HSO 、NaO 和NaCO 溶液的装置,
3 2 2 4 2 2 2 3
充分作用后,最后得到的气体是( )
A.CO 和NO B.CO
2 2
C.NO D.NO
2
11.下列叙述不正确的是( )
A.NH 易液化,液氨常用作制冷剂
3
B.与金属反应时,稀HNO 可能被还原为更低价态,则稀HNO 氧化性强于浓HNO
3 3 3
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.稀HNO 和活泼金属反应时得不到氢气
3
12. 1.92 g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到672 mL气体
(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A.504 mL B.336 mL C.224 mL D.168 mL
13.14 g铜、银合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与 1.12 L(标准状况)氧气混
合通入水中,恰好全部被水吸收,则合金中铜的质量是 ( )
A.9.6 g B.6.4 g C.3.2 g D.4.8 g
14.根据下列实验事实得出的相应结论正确的是( )
选项 实验事实 结论
A NH 的水溶液可以导电 NH 是电解质
3 3
B SO 通入硝酸钡溶液出现白色沉淀 BaSO 不溶于强酸
2 3
C Ca(ClO) 溶液中通入SO 产生白色沉淀 生成CaSO 沉淀
2 2 4
D 硝酸具有挥发性 硝酸不稳定
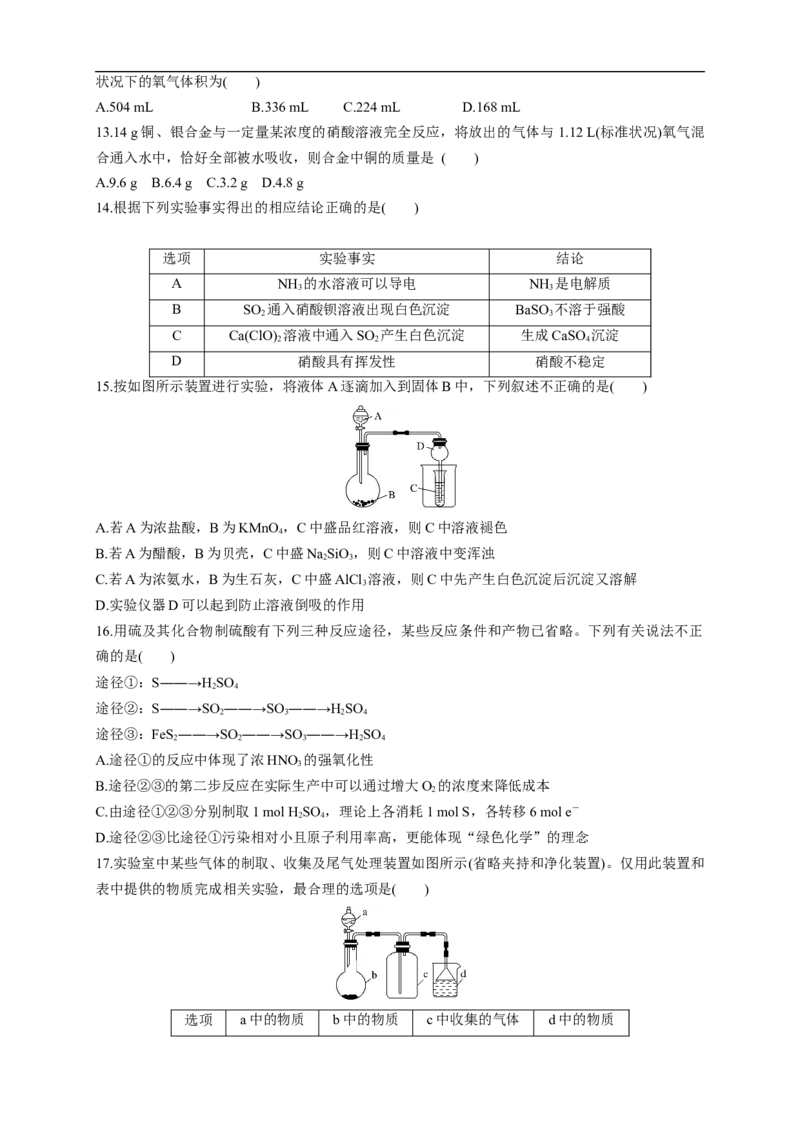
15.按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是( )
A.若A为浓盐酸,B为KMnO ,C中盛品红溶液,则C中溶液褪色
4
B.若A为醋酸,B为贝壳,C中盛NaSiO,则C中溶液中变浑浊
2 3
C.若A为浓氨水,B为生石灰,C中盛AlCl 溶液,则C中先产生白色沉淀后沉淀又溶解
3
D.实验仪器D可以起到防止溶液倒吸的作用
16.用硫及其化合物制硫酸有下列三种反应途径,某些反应条件和产物已省略。下列有关说法不正
确的是( )
途径①:S――→HSO
2 4
途径②:S――→SO ――→SO ――→HSO
2 3 2 4
途径③:FeS――→SO ――→SO ――→HSO
2 2 3 2 4
A.途径①的反应中体现了浓HNO 的强氧化性
3
B.途径②③的第二步反应在实际生产中可以通过增大O 的浓度来降低成本
2
C.由途径①②③分别制取1 mol H SO ,理论上各消耗1 mol S,各转移6 mol e-
2 4
D.途径②③比途径①污染相对小且原子利用率高,更能体现“绿色化学”的理念
17.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和
表中提供的物质完成相关实验,最合理的选项是( )
选项 a中的物质 b中的物质 c中收集的气体 d中的物质A 浓氨水 CaO NH HO
3 2
B 浓硫酸 NaSO SO NaOH溶液
2 3 2
C 稀硝酸 Cu NO HO
2 2
D 浓盐酸 MnO Cl NaOH溶液
2 2
18.如图所示,夹子开始处于关闭状态,将液体 A滴入试管②与气体B充分反应,打开夹子,可发
现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的是( )
A.氢氧化钠溶液、二氧化碳
B.水、氨气
C.氢氧化钠溶液、一氧化氮
D.水、二氧化氮
二、非选择题(本题包括4小题,共46分)
19.(10分)某地酸雨可能含有下表中的离子。取一定量该地酸雨分成 A、B、C、D四份,进行如下
探究:
离子
阳离子 Na+、Mg2+、NH
阴离子 Cl-、SO、SO、NO
请回答下列问题:
(1)该酸雨中肯定存在的离子有___________________________________________________。
(2)不能肯定存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为_____________。
(3)写出溶液中滴加淀粉KI溶液所发生反应的离子方程式:_______________________。
(4)为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO 气体,慢慢通入O ,
2 2
再喷射适量蒸馏水即得硫酸型酸雨,NO的作用为__________________。
20.(12分)在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,
当X无论是强酸还是强碱时,都有如下的转化关系:
――→――→――→――→
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同
一种元素。请回答:
(1)A是________,Y是________,Z是________。
(2)当X是强酸时,E是________。写出B生成C的化学方程式:_________________。
(3)当X是强碱时,E是________,写出B生成C的化学方程式:__________________。
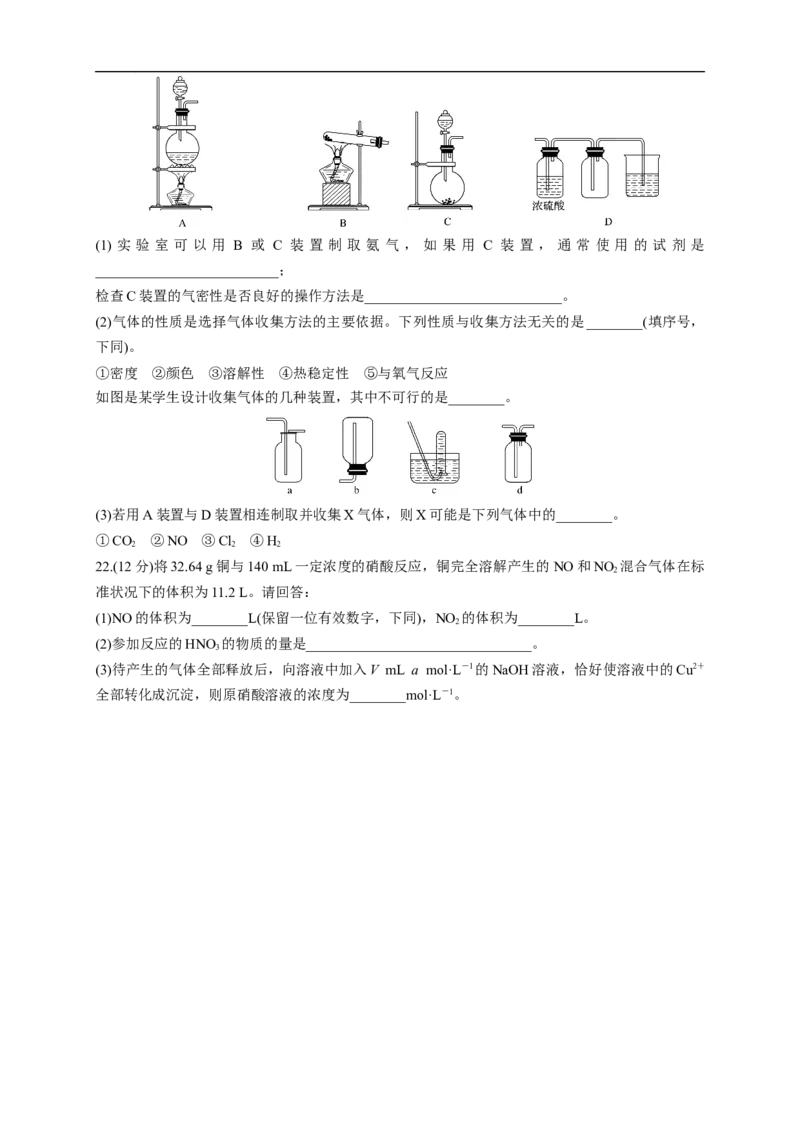
21.(12分)实验室常用的几种气体发生装置如图A、B、C所示。(1) 实 验 室 可 以 用 B 或 C 装 置 制 取 氨 气 , 如 果 用 C 装 置 , 通 常 使 用 的 试 剂 是
__________________________;
检查C装置的气密性是否良好的操作方法是____________________________。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是________(填序号,
下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
如图是某学生设计收集气体的几种装置,其中不可行的是________。
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________。
①CO ②NO ③Cl ④H
2 2 2
22.(12分)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO 混合气体在标
2
准状况下的体积为11.2 L。请回答:
(1)NO的体积为________L(保留一位有效数字,下同),NO 的体积为________L。
2
(2)参加反应的HNO 的物质的量是________________________________。
3
(3)待产生的气体全部释放后,向溶液中加入V mL a mol·L-1的NaOH溶液,恰好使溶液中的Cu2+
全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。