文档内容
第 2 章 第 1 节 化学键与物质构成
一、化学键
1.物质的构成
物质是由分子、原子、离子等微观粒子构成的。氧气、氢气、氯化氢、水等物质由分子构
成;金刚石、石墨、铁、铜等物质由原子构成;氯化钠、氢氧化钠等物质由离子构成。
2.化学键
(1)定义:相邻原子间的强相互作用称为化学键。
(2)类型:分为离子键和共价键。
(3)化学反应的实质是旧化学键断裂和新化学键形成。化学键的断裂与形成伴随着能量的变
化,旧化学键断裂需要吸收能量,新化学键形成会释放能量。
二、离子键和共价键
1.离子键
(1)概念:阴、阳离子之间通过静电作用形成的化学键。
(2)成键条件:成键原子未达到稳定结构且吸引电子能力差别较大。一般情况下,活泼金属
元素原子与活泼非金属元素原子之间容易形成离子键。
(3)离子键的存在:①活泼金属与活泼非金属化合时,一般都能形成离子键。
②金属阳离子与某些带电荷的原子团之间(如Na+与OH-、SO等)能形成离子键。
(4)离子键形成过程的表示方法
①电子式:由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。
②用电子式表示NaCl中离子键的形成过程: 。
2.共价键
(1)概念:原子之间通过共用电子形成的化学键。
(2)实质:共用电子对与成键原子的原子核之间的静电作用。
(3)一般情况下,非金属元素原子之间形成的化学键是共价键。
(4)共价键的存在:①存在于非金属单质中(除稀有气体外)的分子内(包括C、Si等单质)。
②存在于非金属原子形成的化合物中(包括SiO 、SiC等)。③还可以存在于OH-、SO、NH
2
等原子团中。
(5)共价键形成过程表示方法(以HCl形成为例): 。
(6)共价键类型:①极性键:由不同元素的两个原子形成的共价键,如氢氯键、氮氢键。
②非极性键:由同种元素的两个原子形成的共价键,如氢氢键、氯氯键。
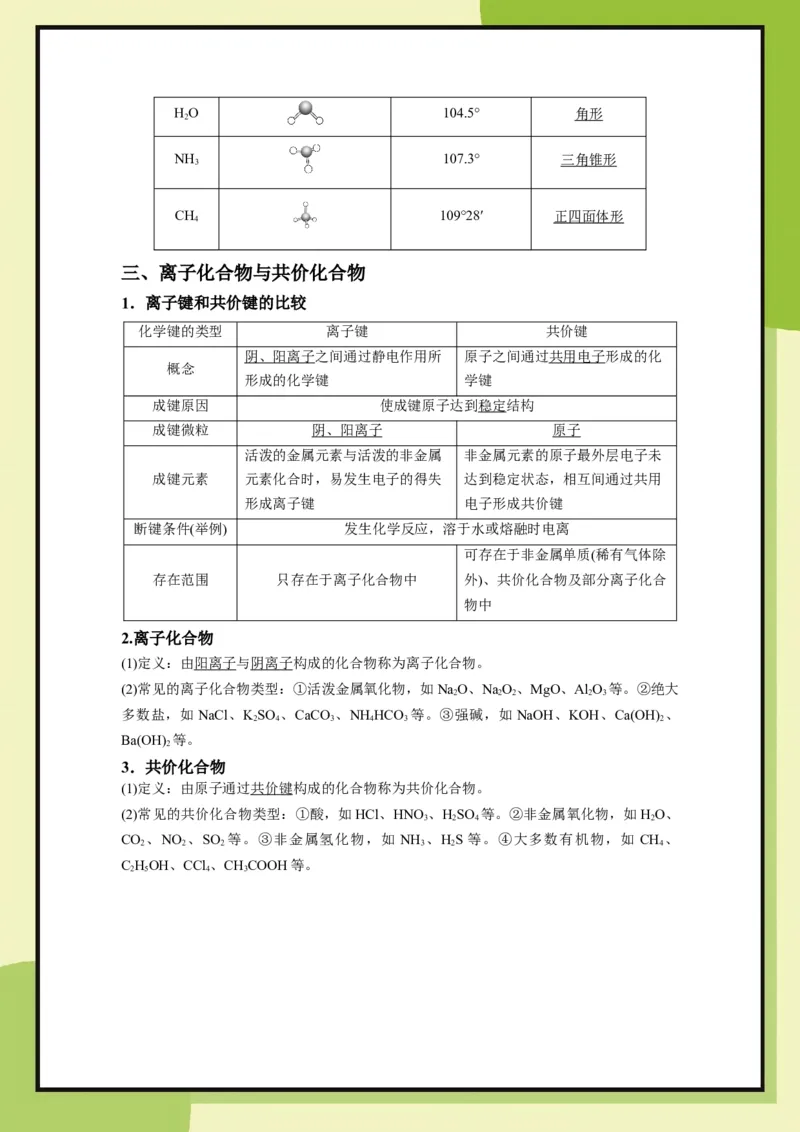
(7)共价键形成的常见分子的空间结构
物质 空间结构示意图 共价键间夹角 分子结构
CO 180° 直线形
2HO 104.5° 角形
2
NH 107.3° 三角锥形
3
CH 109°28′ 正四面体形
4
三、离子化合物与共价化合物
1.离子键和共价键的比较
化学键的类型 离子键 共价键
阴、阳离子之间通过静电作用所 原子之间通过共用电子形成的化
概念
形成的化学键 学键
成键原因 使成键原子达到稳定结构
成键微粒 阴、阳离子 原子
活泼的金属元素与活泼的非金属 非金属元素的原子最外层电子未
成键元素 元素化合时,易发生电子的得失 达到稳定状态,相互间通过共用
形成离子键 电子形成共价键
断键条件(举例) 发生化学反应,溶于水或熔融时电离
可存在于非金属单质(稀有气体除
存在范围 只存在于离子化合物中 外)、共价化合物及部分离子化合
物中
2.离子化合物
(1)定义:由阳离子与阴离子构成的化合物称为离子化合物。
(2)常见的离子化合物类型:①活泼金属氧化物,如NaO、NaO、MgO、Al O 等。②绝大
2 2 2 2 3
多数盐,如NaCl、KSO 、CaCO 、NH HCO 等。③强碱,如NaOH、KOH、Ca(OH) 、
2 4 3 4 3 2
Ba(OH) 等。
2
3.共价化合物
(1)定义:由原子通过共价键构成的化合物称为共价化合物。
(2)常见的共价化合物类型:①酸,如HCl、HNO 、HSO 等。②非金属氧化物,如HO、
3 2 4 2
CO 、NO 、SO 等。③非金属氢化物,如 NH 、HS 等。④大多数有机物,如 CH 、
2 2 2 3 2 4
C HOH、CCl 、CHCOOH等。
2 5 4 3