文档内容
高一下学期第五单元达标检测卷
化 学(A)
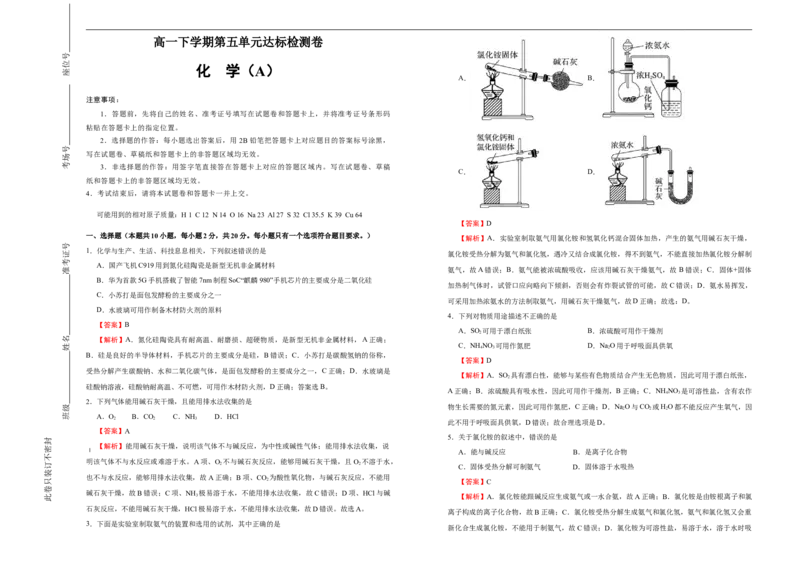
A. B.
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码
粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用 2B铅笔把答题卡上对应题目的答案标号涂黑,
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿
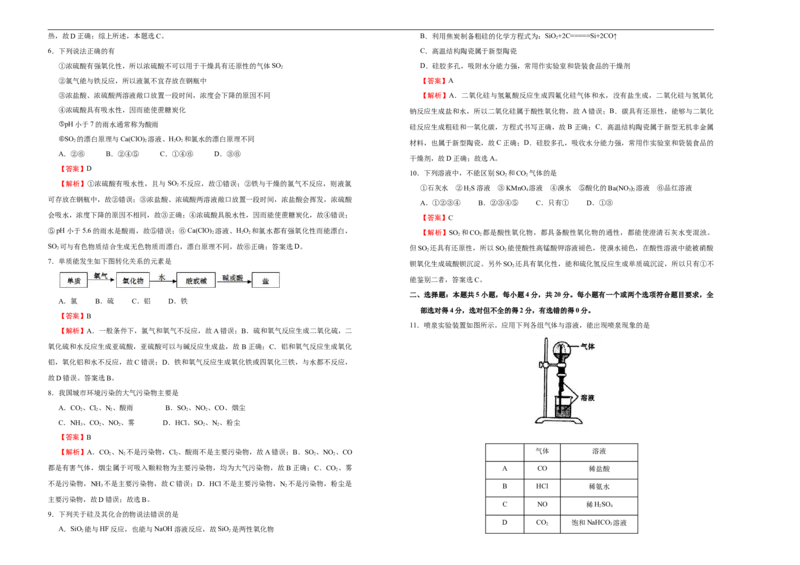
C. D.
纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 K 39 Cu 64
【答案】D
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。)
【解析】A.实验室制取氨气用氯化铵和氢氧化钙混合固体加热,产生的氨气用碱石灰干燥,
1.化学与生产、生活、科技息息相关,下列叙述错误的是
氯化铵受热分解为氨气和氯化氢,遇冷又结合成氯化铵,得不到氨气,不能直接加热氯化铵分解制
A.国产飞机C919用到氮化硅陶瓷是新型无机非金属材料
氨气,故A错误;B.氨气能被浓硫酸吸收,应该用碱石灰干燥氨气,故 B错误;C.固体+固体
B.华为首款5G手机搭载了智能7nm制程SoC“麒麟980”手机芯片的主要成分是二氧化硅
加热制气体时,试管口应向略向下倾斜,否则会有炸裂试管的可能,故C错误;D.氨水易挥发,
C.小苏打是面包发酵粉的主要成分之一
可采用加热浓氨水的方法制取氨气,用碱石灰干燥氨气,故D正确;故选:D。
D.水玻璃可用作制备木材防火剂的原料
4.下列对物质用途描述不正确的是
【答案】B
A.SO 可用于漂白纸张 B.浓硫酸可用作干燥剂
2
【解析】A.氮化硅陶瓷具有耐高温、耐磨损、超硬物质,是新型无机非金属材料,A正确;
C.NH NO 可用作氮肥 D.NaO用于呼吸面具供氧
4 3 2
B.硅是良好的半导体材料,手机芯片的主要成分是硅,B错误;C.小苏打是碳酸氢钠的俗称,
【答案】D
受热分解产生碳酸钠、水和二氧化碳气体,是面包发酵粉的主要成分之一,C正确;D.水玻璃是
【解析】A.SO 具有漂白性,能够与某些有色物质结合产生无色物质,因此可用于漂白纸张,
2
硅酸钠溶液,硅酸钠耐高温、不可燃,可用作木材防火剂,D正确;答案选B。
A正确;B.浓硫酸具有吸水性,因此可用作干燥剂,B正确;C.NH NO 是可溶性盐,含有农作
4 3
2.下列气体能用碱石灰干燥,且能用排水法收集的是
物生长需要的氮元素,因此可用作氮肥,C正确;D.NaO与CO 或HO都不能反应产生氧气,因
2 2 2
A.O B.CO C.NH D.HCl
2 2 3
此不用于呼吸面具供氧,D错误;故合理选项是D。
【答案】A
5.关于氯化铵的叙述中,错误的是
【解析】能用碱石灰干燥,说明该气体不与碱反应,为中性或碱性气体;能用排水法收集,说
A.能与碱反应 B.是离子化合物
明该气体不与水反应或难溶于水。A项、O 不与碱石灰反应,能够用碱石灰干燥,且O 不溶于水,
2 2 C.固体受热分解可制氨气 D.固体溶于水吸热
也不与水反应,能够用排水法收集,故A正确;B项、CO 为酸性氧化物,与碱石灰反应,不能用
2 【答案】C
碱石灰干燥,故B错误;C项、NH 极易溶于水,不能用排水法收集,故C错误;D项、HCl与碱
3 【解析】A.氯化铵能跟碱反应生成氨气或一水合氨,故A正确;B.氯化铵是由铵根离子和氯
石灰反应,不能用碱石灰干燥,HCl极易溶于水,不能用排水法收集,故D错误。故选A。
离子构成的离子化合物,故B正确;C.氯化铵受热分解生成氨气和氯化氢,氨气和氯化氢又会重
3.下面是实验室制取氨气的装置和选用的试剂,其中正确的是
新化合生成氯化铵,不能用于制氨气,故C错误;D.氯化铵为可溶性盐,易溶于水,溶于水时吸
封密不订装只卷此
号位座
号场考
号证考准
名姓
级班热,故D正确;综上所述,本题选C。 B.利用焦炭制备粗硅的化学方程式为:SiO+2C=====Si+2CO↑
2
6.下列说法正确的有 C.高温结构陶瓷属于新型陶瓷
①浓硫酸有强氧化性,所以浓硫酸不可以用于干燥具有还原性的气体SO D.硅胶多孔,吸附水分能力强,常用作实验室和袋装食品的干燥剂
2
②氯气能与铁反应,所以液氯不宜存放在钢瓶中 【答案】A
③浓盐酸、浓硫酸两溶液敞口放置一段时间,浓度会下降的原因不同 【解析】A.二氧化硅与氢氟酸反应生成四氟化硅气体和水,没有盐生成,二氧化硅与氢氧化
④浓硫酸具有吸水性,因而能使蔗糖炭化 钠反应生成盐和水,所以二氧化硅属于酸性氧化物,故A错误;B.碳具有还原性,能够与二氧化
⑤pH小于7的雨水通常称为酸雨
硅反应生成粗硅和一氧化碳,方程式书写正确,故B正确;C.高温结构陶瓷属于新型无机非金属
⑥SO 的漂白原理与Ca(ClO) 溶液、HO 和氯水的漂白原理不同
2 2 2 2 材料,也属于新型陶瓷,故C正确;D.硅胶多孔,吸收水分能力强,常用作实验室和袋装食品的
A.②⑥ B.②④⑤ C.①④⑥ D.③⑥
干燥剂,故D正确;故选A。
【答案】D
10.下列溶液中,不能区别SO 和CO 气体的是
2 2
【解析】①浓硫酸有吸水性,且与SO 不反应,故①错误;②铁与干燥的氯气不反应,则液氯
2 ①石灰水 ②HS溶液 ③KMnO 溶液 ④溴水 ⑤酸化的Ba(NO ) 溶液 ⑥品红溶液
2 4 3 2
可存放在钢瓶中,故②错误;③浓盐酸、浓硫酸两溶液敞口放置一段时间,浓盐酸会挥发,浓硫酸
A.①②③④ B.②③④⑤ C.只有① D.①③
会吸水,浓度下降的原因不相同,故③正确;④浓硫酸具脱水性,因而能使蔗糖炭化,故④错误;
【答案】C
⑤pH小于5.6的雨水是酸雨,故⑤错误;⑥Ca(ClO) 2 溶液、H 2 O 2 和氯水都有强氧化性而能漂白, 【解析】SO 2 和CO 2 都是酸性氧化物,都具备酸性氧化物的通性,都能使澄清石灰水变混浊。
SO 2 可与有色物质结合生成无色物质而漂白,漂白原理不同,故⑥正确;答案选D。 但SO 2 还具有还原性,所以SO 2 能使酸性高锰酸钾溶液褪色,使溴水褪色,在酸性溶液中能被硝酸
7.单质能发生如下图转化关系的元素是
钡氧化生成硫酸钡沉淀。另外SO 还具有氧化性,能和硫化氢反应生成单质硫沉淀,所以只有①不
2
能鉴别二者,答案选C。
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全
A.氯 B.硫 C.铝 D.铁
部选对得4分,选对但不全的得2分,有选错的得0分。
【答案】B
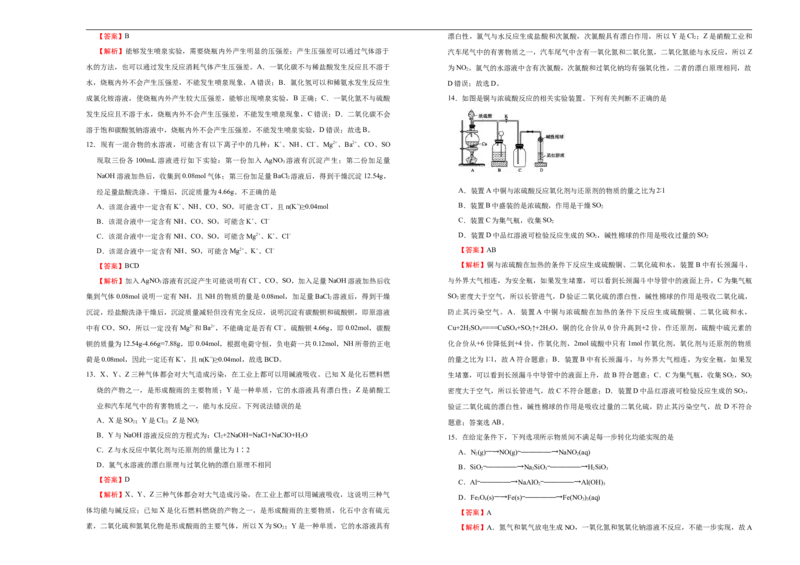
11.喷泉实验装置如图所示。应用下列各组气体与溶液,能出现喷泉现象的是
【解析】A.一般条件下,氯气和氧气不反应,故A错误;B.硫和氧气反应生成二氧化硫,二
氧化硫和水反应生成亚硫酸,亚硫酸可以与碱反应生成盐,故 B正确;C.铝和氧气反应生成氧化
铝,氧化铝和水不反应,故C错误;D.铁和氧气反应生成氧化铁或四氧化三铁,与水都不反应,
故D错误。答案选B。
8.我国城市环境污染的大气污染物主要是
A.CO、Cl、N、酸雨 B.SO 、NO 、CO、烟尘
2 2 2 2 2
C.NH 、CO、NO 、雾 D.HCl、SO 、N、粉尘
3 2 2 2 2
【答案】B
【解析】A.CO 、N 不是污染物,Cl 、酸雨不是主要污染物,故A错误;B.SO 、NO 、CO 气体 溶液
2 2 2 2 2
都是有害气体,烟尘属于可吸入颗粒物为主要污染物,均为大气污染物,故B正确;C.CO 、雾 A CO 稀盐酸
2
不是污染物,NH 不是主要污染物,故C错误;D.HCl不是主要污染物,N 不是污染物,粉尘是
3 2 B HCl 稀氨水
主要污染物,故D错误;故选B。
C NO 稀HSO
2 4
9.下列关于硅及其化合的物说法错误的是
D CO 饱和NaHCO 溶液
2 3
A.SiO 能与HF反应,也能与NaOH溶液反应,故SiO 是两性氧化物
2 2【答案】B 漂白性,氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白作用,所以 Y是Cl ;Z是硝酸工业和
2
【解析】能够发生喷泉实验,需要烧瓶内外产生明显的压强差;产生压强差可以通过气体溶于 汽车尾气中的有害物质之一,汽车尾气中含有一氧化氮和二氧化氮,二氧化氮能与水反应,所以Z
水的方法,也可以通过发生反应消耗气体产生压强差。A.一氧化碳不与稀盐酸发生反应且不溶于 为NO 。氯气的水溶液中含有次氯酸,次氯酸和过氧化钠均有强氧化性,二者的漂白原理相同,故
2
水,烧瓶内外不会产生压强差,不能发生喷泉现象,A错误;B.氯化氢可以和稀氨水发生反应生 D错误;故选D。
成氯化铵溶液,使烧瓶内外产生较大压强差,能够出现喷泉实验,B正确;C.一氧化氮不与硫酸 14.如图是铜与浓硫酸反应的相关实验装置。下列有关判断不正确的是
发生反应且不溶于水,烧瓶内外不会产生压强差,不能发生喷泉现象,C错误;D.二氧化碳不会
溶于饱和碳酸氢钠溶液中,烧瓶内外不会产生压强差,不能发生喷泉实验,D错误;故选B。
12.现有一混合物的水溶液,可能含有以下离子中的几种:K+、NH、Cl−、Mg2+、Ba2+、CO、SO
现取三份各100mL溶液进行如下实验:第一份加入AgNO 溶液有沉淀产生;第二份加足量
3
NaOH溶液加热后,收集到0.08mol气体;第三份加足量BaCl 溶液后,得到干燥沉淀12.54g,
2
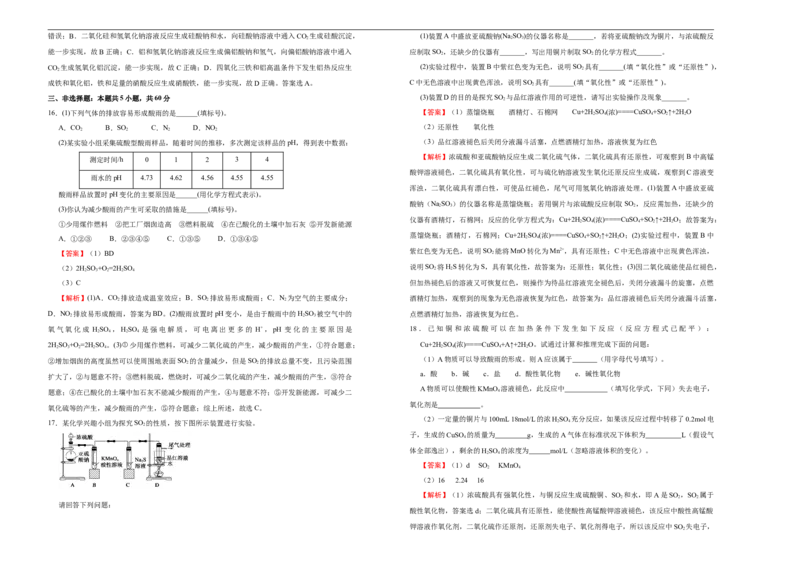
经足量盐酸洗涤、干燥后,沉淀质量为4.66g。不正确的是 A.装置A中铜与浓硫酸反应氧化剂与还原剂的物质的量之比为2∶1
A.该混合液中一定含有K+、NH、CO、SO,可能含Cl−,且n(K+)≥0.04mol B.装置B中盛装的是浓硫酸,作用是干燥SO
2
B.该混合液中一定含有NH、CO、SO,可能含K+、Cl− C.装置C为集气瓶,收集SO
2
C.该混合液中一定含有NH、CO、SO,可能含Mg2+、K+、Cl− D.装置D中品红溶液可检验反应生成的SO
2
,碱性棉球的作用是吸收过量的SO
2
D.该混合液中一定含有NH、SO,可能含Mg2+、K+、Cl− 【答案】AB
【答案】BCD 【解析】铜与浓硫酸在加热的条件下反应生成硫酸铜、二氧化硫和水,装置 B中有长颈漏斗,
【解析】加入AgNO 溶液有沉淀产生可能说明有Cl−、CO、SO,加入足量NaOH溶液加热后收 与外界大气相连,为安全瓶,如果发生堵塞,可以看到长颈漏斗中导管中的液面上升,C为集气瓶
3
集到气体0.08mol说明一定有NH,且NH的物质的量是0.08mol,加足量BaCl 溶液后,得到干燥 SO 密度大于空气,所以长管进气,D验证二氧化硫的漂白性,碱性棉球的作用是吸收二氧化硫,
2 2
沉淀,经盐酸洗涤干燥后,沉淀质量减轻但没有完全反应,说明沉淀有碳酸钡和硫酸钡,即原溶液 防止其污染空气。A.装置A中铜与浓硫酸在加热的条件下反应生成硫酸铜、二氧化硫和水,
中有CO、SO,所以一定没有Mg2+和Ba2+,不能确定是否有Cl−。硫酸钡4.66g,即0.02mol,碳酸 Cu+2H SO ====CuSO +SO↑+2H O,铜的化合价从0价升高到+2价,作还原剂,硫酸中硫元素的
2 4 4 2 2
钡的质量为12.54g-4.66g=7.88g,即0.04mol,根据电荷守恒,负电荷一共0.12mol,NH所带的正电 化合价从+6价降低到+4价,作氧化剂,2mol硫酸中只有1mol作氧化剂,氧化剂与还原剂的物质
荷是0.08mol,因此一定还有K+,且n(K+)≥0.04mol,故选BCD。 的量之比为1∶1,故A符合题意;B.装置B中有长颈漏斗,与外界大气相连,为安全瓶,如果发
13.X、Y、Z三种气体都会对大气造成污染,在工业上都可以用碱液吸收。已知X是化石燃料燃 生堵塞,可以看到长颈漏斗中导管中的液面上升,故B符合题意;C.C为集气瓶,收集SO ,SO
2 2
烧的产物之一,是形成酸雨的主要物质;Y是一种单质,它的水溶液具有漂白性;Z是硝酸工 密度大于空气,所以长管进气,故C不符合题意;D.装置D中品红溶液可检验反应生成的SO ,
2
业和汽车尾气中的有害物质之一,能与水反应。下列说法错误的是 验证二氧化硫的漂白性,碱性棉球的作用是吸收过量的二氧化硫,防止其污染空气,故 D不符合
A.X是SO 2 ;Y是Cl 2 ;Z是NO 2 题意;答案选AB。
B.Y与NaOH溶液反应的方程式为:Cl 2 +2NaOH=NaCl+NaClO+H 2 O 15.在给定条件下,下列选项所示物质间不满足每一步转化均能实现的是
C.Z与水反应中氧化剂与还原剂的质量比为1∶2 A.N(g)――→NO(g)―————→NaNO (aq)
2 2
D.氯气水溶液的漂白原理与过氧化钠的漂白原理不相同 B.SiO―————→NaSiO―————→HSiO
2 2 3 2 3
【答案】D
C.Al―————→NaAlO ―————→Al(OH)
2 3
【解析】X、Y、Z三种气体都会对大气造成污染,在工业上都可以用碱液吸收,这说明三种气
D.Fe O(s)――→Fe(s)―————→Fe(NO )(aq)
3 4 3 3
体均能与碱反应;已知X是化石燃料燃烧的产物之一,是形成酸雨的主要物质,化石中含有硫元
【答案】A
素,二氧化硫和氮氧化物是形成酸雨的主要气体,所以X为SO 2 ;Y是一种单质,它的水溶液具有 【解析】A.氮气和氧气放电生成NO,一氧化氮和氢氧化钠溶液不反应,不能一步实现,故A错误;B.二氧化硅和氢氧化钠溶液反应生成硅酸钠和水,向硅酸钠溶液中通入CO 生成硅酸沉淀, (1)装置A中盛放亚硫酸钠(Na SO )的仪器名称是_______,若将亚硫酸钠改为铜片,与浓硫酸反
2 2 3
能一步实现,故B正确;C.铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,向偏铝酸钠溶液中通入 应制取SO ,还缺少的仪器有_______,写出用铜片制取SO 的化学方程式_______。
2 2
CO 2 生成氢氧化铝沉淀,能一步实现,故C正确;D.四氧化三铁和铝高温条件下发生铝热反应生 (2)实验过程中,装置B中紫红色变为无色,说明SO 2 具有_______(填“氧化性”或“还原性”),
成铁和氧化铝,铁和足量的硝酸反应生成硝酸铁,能一步实现,故D正确。答案选A。 C中无色溶液中出现黄色浑浊,说明SO
2
具有_______(填“氧化性”或“还原性”)。
三、非选择题:本题共5小题,共60分 (3)装置D的目的是探究SO 与品红溶液作用的可逆性,请写出实验操作及现象_______。
2
16.(1)下列气体的排放容易形成酸雨的是______(填标号)。 【答案】(1)蒸馏烧瓶 酒精灯、石棉网 Cu+2HSO (浓)====CuSO +SO ↑+2HO
2 4 4 2 2
A.CO B.SO C.N D.NO (2)还原性 氧化性
2 2 2 2
(2)某实验小组采集硫酸型酸雨样品,随着时间的推移,多次测定该样品的pH,得到表中数据: (3)品红溶液褪色后关闭分液漏斗活塞,点燃酒精灯加热,溶液恢复为红色
【解析】浓硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫具有还原性,可观察到 B中高锰
测定时间/h 0 1 2 3 4
酸钾溶液褪色,二氧化硫具有氧化性,可与硫化钠溶液发生氧化还原反应生成硫,观察到C溶液变
雨水的pH 4.73 4.62 4.56 4.55 4.55
浑浊,二氧化硫具有漂白性,可使品红褪色,尾气可用氢氧化钠溶液处理。(1)装置A中盛放亚硫
酸雨样品放置时pH变化的主要原因是______(用化学方程式表示)。
酸钠(NaSO )的仪器名称是蒸馏烧瓶;若用铜片与浓硫酸反应制取SO ,反应需加热,还缺少的
2 3 2
(3)你认为减少酸雨的产生可采取的措施是______(填标号)。
仪器有酒精灯,石棉网;反应的化学方程式为:Cu+2HSO (浓)====CuSO +SO ↑+2HO;故答案为:
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源 2 4 4 2 2
蒸馏烧瓶;酒精灯,石棉网;Cu+2HSO (浓)====CuSO +SO ↑+2HO;(2)实验过程中,装置B中
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤ 2 4 4 2 2
紫红色变为无色,说明SO 能将MnO转化为Mn2+,具有还原性;C中无色溶液中出现黄色浑浊,
【答案】(1)BD 2
(2)2H 2 SO 3 +O 2 =2H 2 SO 4 说明SO 2 将H 2 S转化为S,具有氧化性,故答案为:还原性;氧化性;(3)因二氧化硫能使品红褪色,
(3)C 但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃
【解析】(1)A.CO 排放造成温室效应;B.SO 排放易形成酸雨;C.N 为空气的主要成分; 酒精灯加热,观察到的现象为无色溶液恢复为红色,故答案为:品红溶液褪色后关闭分液漏斗活塞,
2 2 2
D.NO 排放易形成酸雨,答案为BD。(2)酸雨放置时pH变小,是由于酸雨中的HSO 被空气中的 点燃酒精灯加热,溶液恢复为红色。
2 2 3
氧气氧化成 HSO ,HSO 是强电解质,可电离出更多的 H+,pH 变化的主要原因是 18.已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
2 4 2 4
2H
2
SO
3
+O
2
=2H
2
SO
4
。(3)①少用煤作燃料,可减少二氧化硫的产生,减少酸雨的产生,①符合题意; Cu+2H
2
SO
4
(浓)====CuSO
4
+A↑+2H
2
O。试通过计算和推理完成下面的问题:
②增加烟囱的高度虽然可以使周围地表面SO 的含量减少,但是SO 的排放总量不变,且污染范围 (1)A物质可以导致酸雨的形成。则A应该属于 (用字母代号填写)。
2 2
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
扩大了,②与题意不符;③燃料脱硫,燃烧时,可减少二氧化硫的产生,减少酸雨的产生,③符合
A物质可以使酸性KMnO 溶液褪色,此反应中 (填写化学式,下同)失去电子,
题意;④在已酸化的土壤中加石灰不能减少酸雨的产生,④与题意不符;⑤开发新能源,可减少二 4
氧化剂是 。
氧化硫等的产生,减少酸雨的产生,⑤符合题意;综上所述,故选C。
(2)一定量的铜片与100mL 18mol/L的浓HSO 充分反应,如果该反应过程中转移了0.2mol电
17.某化学兴趣小组为探究SO 的性质,按下图所示装置进行实验。 2 4
2
子,生成的CuSO 的质量为 g,生成的A气体在标准状况下体积为 L(假设气
4
体全部逸出),剩余的HSO 的浓度为 mol/L(忽略溶液体积的变化)。
2 4
【答案】(1)d SO KMnO
2 4
(2)16 2.24 16
【解析】(1)浓硫酸具有强氧化性,与铜反应生成硫酸铜、SO 和水,即A是SO ,SO 属于
2 2 2
请回答下列问题:
酸性氧化物,答案选d;二氧化硫具有还原性,能使酸性高锰酸钾溶液褪色,该反应中酸性高锰酸
钾溶液作氧化剂,二氧化硫作还原剂,还原剂失电子、氧化剂得电子,所以该反应中SO 失电子,
2氧化剂是KMnO ;(2)铜元素化合价从0价升高到+2价,失去2个电子,根据转移电子守恒得溶 (6)①②⑤
4
解的n(Cu)=0.2mol÷2=0.1mol,根据Cu原子守恒得n(CuSO
4
)=n(Cu)=0.1mol,硫酸铜质量 【解析】工业废气和过量石灰乳反应生成碳酸钙、亚硫酸钙,剩余 NO、CO、N
2
,加入适量的
=nM=0.1mol×160g/mol=16g。根据方程式可知二氧化硫的物质的量是0.1mol,在标准状况下的体积 空气,部分NO与氧气反应生成NO
2
,NO、NO
2
和NaOH反应生成NaNO
2
,亚硝酸根和铵根反应
=0.1mol×22.4L/mol=2.24L;反应前硫酸的物质的量是 1.8mol,生成二氧化硫是0.1mol,硫酸铜是 生成水和氮气,剩余的气体是CO和N
2
,用捕获剂在一定条件下捕获到CO。(1)NO是无色的气体,
0.1mol,所以根据硫原子守恒可知剩余硫酸的物质的量是 1.8mol-0.1mol-0.1mol=1.6mol,浓度是 难溶于水;NO
2
能与水发生反应生成硝酸和NO,其反应的化学方程式为3NO
2
+H
2
O=2HNO
3
+NO;
1.6mol÷0.1L=16mol/L。 故答案为:无;难;3NO
2
+H
2
O=2HNO
3
+NO。(2)SO
2
易与雨水反应生成亚硫酸,亚硫酸和空气中氧
19.氮氧化合物和二氧化硫是引起雾霾重要物质,工业用多种方法来治理。某种综合处理含NH废 气反应生成硫酸,因此SO 形成的一种常见的环境污染为酸雨;故答案为:酸雨。(3)CO 、SO 与
2 2 2
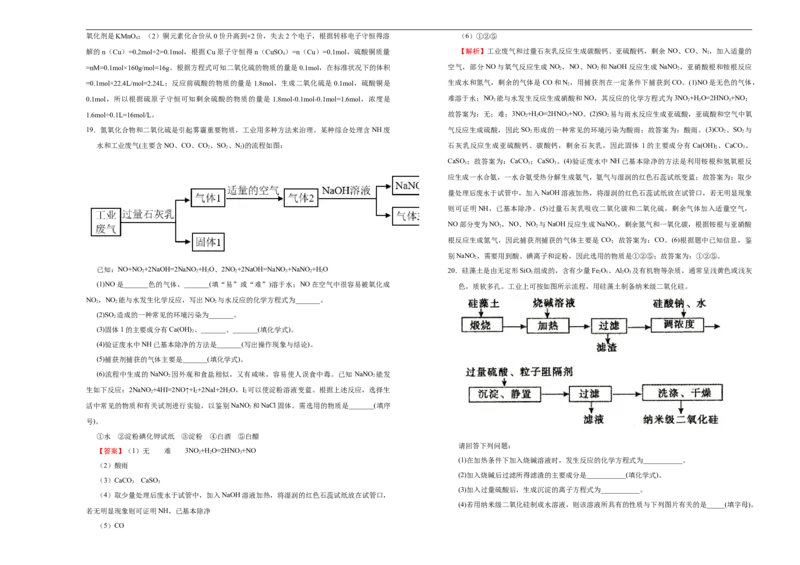
水和工业废气(主要含NO、CO、CO、SO 、N)的流程如图: 石灰乳反应生成亚硫酸钙、碳酸钙,剩余石灰乳,因此固体 1的主要成分有Ca(OH) 、CaCO 、
2 2 2 2 3
CaSO ;故答案为:CaCO ;CaSO 。(4)验证废水中NH已基本除净的方法是利用铵根和氢氧根反
3 3 3
应生成一水合氨,一水合氨受热分解生成氨气,氨气与湿润的红色石蕊试纸变蓝;故答案为:取少
量处理后废水于试管中,加入NaOH溶液加热,将湿润的红色石蕊试纸放在试管口,若无明显现象
则可证明NH,已基本除净。(5)过量石灰乳吸收二氧化碳和二氧化硫,剩余气体加入适量空气,
NO部分变为NO ,NO、NO 与NaOH反应生成NaNO ,剩余氮气和一氧化碳,根据铵根与亚硝酸
2 2 2
根反应生成氮气,因此捕获剂捕获的气体主要是 CO;故答案为:CO。(6)根据题中已知信息,鉴
别NaNO ,需要用到酸、碘离子和淀粉,因此选用的物质是①②⑤;故答案为:①②⑤。
2
已知:NO+NO 2 +2NaOH=2NaNO 2 +H 2 O、2NO 2 +2NaOH=NaNO 3 +NaNO 2 +H 2 O 20.硅藻土是由无定形SiO 2 组成的,含有少量Fe 2 O 3 、Al 2 O 3 及有机物等杂质,通常呈浅黄色或浅灰
(1)NO是_______色的气体,_______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成
色,质软多孔。工业上可按如图所示流程,用硅藻土制备纳米级二氧化硅。
NO ,NO 能与水发生化学反应,写出NO 与水反应的化学方程式为_______。
2 2 2
(2)SO 造成的一种常见的环境污染为_______。
2
(3)固体1的主要成分有Ca(OH) 、_______、_______(填化学式)。
2
(4)验证废水中NH已基本除净的方法是_______(写出操作现象与结论)。
(5)捕获剂捕获的气体主要是_______(填化学式)。
(6)流程中生成的NaNO 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO 能发
2 2
生如下反应:2NaNO +4HI=2NO↑+I+2NaI+2HO,I 可以使淀粉溶液变蓝。根据上述反应,选择生
2 2 2 2
活中常见的物质和有关试剂进行实验,以鉴别NaNO 和NaCl固体。需选用的物质是_______(填序
2
号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
请回答下列问题:
【答案】(1)无 难 3NO +HO=2HNO+NO
2 2 3
(1)在加热条件下加入烧碱溶液时,发生反应的化学方程式为___________。
(2)酸雨
(2)加入烧碱后过滤所得滤渣的主要成分是___________(填化学式)。
(3)CaCO CaSO
3 3
(3)加入过量硫酸后,生成沉淀的离子方程式为___________。
(4)取少量处理后废水于试管中,加入NaOH溶液加热,将湿润的红色石蕊试纸放在试管口,
(4)若用纳米级二氧化硅制成水溶液,则该溶液所具有的性质与下列图片有关的是_____(填字母)。
若无明显现象则可证明NH,已基本除净
(5)CO【答案】(1) 、
(2)
(3)
(4)AC
【解析】硅藻土中的有机杂质可以通过煅烧的方式除去,然后加入烧碱溶液,二氧化硅和氧化
铝均溶解,氧化铁不溶,过滤除去,利用硅酸钠和水调节浓度,利用过量硫酸使偏铝酸根离子转化
为铝离子,最后过滤洗涤得到纳米级二氧化硅。(1)在加热条件下加入烧碱溶液时二氧化硅和氧化
铝 溶 解 , 发 生 反 应 的 化 学 方 程 式 为 、
。(2)氧化铁不溶于烧碱,加入烧碱后过滤所得滤渣的主要成
分是 。(3)加入过量硫酸后,生成硅酸沉淀的离子方程式为 。(4)若用
纳米级二氧化硅制成水溶液,则该溶液形成的分散系属于胶体,具有胶体的性质,A和C均是丁达
尔效应,B中硫酸铜溶液不能发生丁达尔效应,答案选AC。